
【题目】下列实验的实验操作、实验现象和实验结论都正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 室温下,向铝箔上滴加浓硫酸 | 无明显现象 | 铝与浓硫酸不反应 |
B | 将二氧化硫通入紫色石蕊试液 | 先变红后褪色 | 二氧化硫是酸性氧化物,还具有漂白性 |
C | 在氯化银悬浊液中滴加少量KBr稀溶液 | 白色浑浊变为淡黄色浑浊 | Ksp(AgCl)>Ksp (AgBr) |
D | NaAlO2溶液中滴加 NaHCO3溶液 | 产生白色沉淀 | N aAlO2和Na HCO3发生相互促进的水解反应 |
A. A B. B C. C D. D
【答案】C
【解析】
A. 室温下,铝与浓硫酸发生钝化;
B. 二氧化硫通入紫色石蕊试液,溶液会变红,但不会褪色;
C. 难溶沉淀转化为更难溶的沉淀,发生沉淀的转化;
D. AlO2-促进 HCO3-的电离,生成白色沉淀;
A.铝与浓硫酸发生钝化,阻止反应的进一步发生,观察不到明显现象,但发生了氧化还原反应,故A项错误;
B. 二氧化硫是酸性氧化物,可以使紫色石蕊试液变红,但二氧化硫只能使品红溶液褪色,不能使紫色石蕊试液褪色,则现象和结论不正确,故B项错误;
C. AgBr比AgCl难溶,当在氯化银悬浊液中滴加少量KBr稀溶液,会发生反应AgCl(s)+Br- ![]() AgBr(s)+Cl-,则白色浑浊变为淡黄色浑浊,相同类型的难溶物,其溶解度越小,对应的Ksp越小,所以实验操作、实验现象和实验结论都正确,故C项正确;
AgBr(s)+Cl-,则白色浑浊变为淡黄色浑浊,相同类型的难溶物,其溶解度越小,对应的Ksp越小,所以实验操作、实验现象和实验结论都正确,故C项正确;
D. NaAlO2溶液中滴加 NaHCO3溶液,发生反应:AlO2-+HCO3-+H2O = Al(OH)3↓+ CO32-,所以AlO2-促进了HCO3-的电离,跟HCO3-的水解无关,则结论错误,故D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. X的正反应速率是Y的逆反应速率的m/n倍
B. 通入稀有气体使压强增大,平衡将正向移动
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给150mL某液体加热的操作中,所需的仪器是( )
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网 ⑥泥三角 ⑦坩埚 ⑧铁三脚架
A.③⑥⑦⑧B.②③⑤⑧C.①③④⑤D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解,回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和_________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
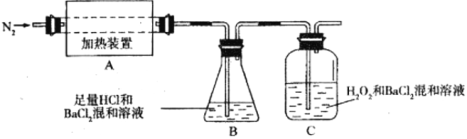
①为验证A中残留物是否含有FeO,需要选用的试剂有_________。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有_________气体生成,若含有该气体,观察到的现象为___________________。
③若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b_________a(填“大于”、“小于”或“等于”)
④实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为________________。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的含量,某实验小组做了如下实验:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:
步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL。
①步骤二达到滴定终点的标志为________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
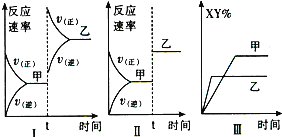
A. 图I是升高温度的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com