
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
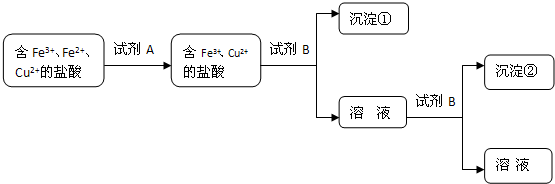
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.0 | 3.0 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
| B、氯化铝溶液中加入过量的氨Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ |
| D、小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某化合物溶于水导电,则该化合物为电解质 |
| B、NaCl溶液在电流作用下电离成Na+和Cl- |
| C、在氧化还原反应中,非金属单质一定是氧化剂 |
| D、元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液中加入过量的Fe粉:Fe3++Fe2Fe2+ |
| B、SO2通入溴水中:SO2+2H2O+Br22H++SO42-+2HBr |
| C、AgNO3溶液中加入过量的氨水:Ag++NH3═H2OAgOH↓+NH4+ |
| D、泡沫灭火器灭火原理:3HCO3-+Al3+3CO2↑+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
125 53 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
131 53 |
137 55 |
| A、碘-131的中子数为78 |
| B、碘-131质量数为53 |
| C、碘与铯互称同位素 |
| D、铯-137的放射性是化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
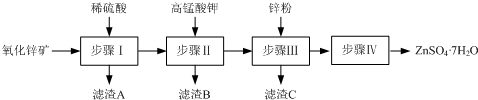
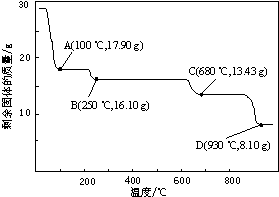
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com