
分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识 进行分类,其中甲与乙
进行分类,其中甲与乙 、丙、丁是包含关系。下列各组中,正确的组合是( )
、丙、丁是包含关系。下列各组中,正确的组合是( )
选项 | 甲 | 乙、丙、丁 |
A | 纯净物 | 液氯、水玻璃、明矾 |
B | 非电解质 | 冰醋酸、SO2、乙醇 |
C | 弱电解质 | CH3COOH 、氨水、H2O |
D | 碱性氧化物 | CaO、Na2O、K2O |
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu=2Fe2++Cu2+
C.向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2017届四川省泸州市高三上10月月考化学卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→FeO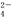 +Cl-+H2O(未配平),下列有关说法不正确的是( )
+Cl-+H2O(未配平),下列有关说法不正确的是( )
A.由上述反应可知,Fe(OH)3的氧化性强于FeO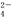
B.高铁酸钾中铁显+6价
C.上述反应中氧化剂和还原剂的物质的量之比为3∶2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:实验题
在Cl-的物质的量浓度为0.5mol•L-1的某无色 澄清溶液中,还可能含有如表中所示的若干种离子.
澄清溶液中,还可能含有如表中所示的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3 |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液200mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子是
(2)实验Ⅰ中生成气体的离子方程式为
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴 离子及其浓度(不一定要填满).
离子及其浓度(不一定要填满).
阴离子 | 浓度c/(mol/L) |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: _
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的3 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法错误的是( )
A.NH4CuSO3中只有Cu元素被氧化
B.反应中硫酸作氧化剂
C.刺激性气味的气体是二氧化硫
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
下列操作中错误的是( )
A.除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液
B.除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥
C.除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶
D.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题:

(1)若A为短周期金厲单质,D为短周期非金厲单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为____________,反应④的化学方程式为_________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,反应④可以在光照条件下发生反应①和反应②在水溶液中进行,反应②的离子方程式是__________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________。标准状况下3.36L物质E与含氢氧化钠10.0g的溶液充分反应,所得溶液中溶质成分为___________(写出化学式和对应的物质的量)
查看答案和解析>>
科目:高中化学 来源:2017届山东省临沂市高三上学期期中化学试卷(解析版) 题型:实验题
摩尔盐[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物。某学习小组欲探究其分解产物。
I.甲组同学设计了如下实验装置。
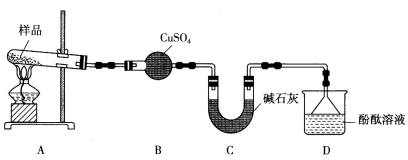
(1)实验中,装置B中观察到的现象是____________________。
(2)碱石灰的主要作用是__________________。
(3)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有_____________(写化学式)。
(4)设计实验验证装置A中固体残留物不含FeO:___________________(简要说明实验操作、现象和结论)。
Ⅱ.乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和下列所示装置进行实验。
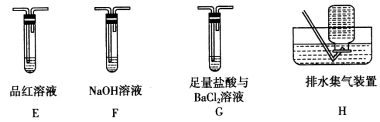
(5)乙组同学的实验装置中,依次连接的合理顺序为A、__________。装置G中盐酸的作用是_________________。
(6)实验中,准确称量摩尔盐7.8400 g,充分加热反应后,测得装置A中固体残留物的质量为1.6000 g,装置G中生成白色沉淀的质量为3.4950 g,装置H中收集到112 mL N2(标准状况下),写出摩尔盐受热分解的化学方程式:___________________。(分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省宁德市高二上期中化学试卷(解析版) 题型:实验题
废铅蓄电池量急速增加所引起的铅污染日益严重。工业上从废铅蓄电池的铅膏中回收铅的工艺流程如下:
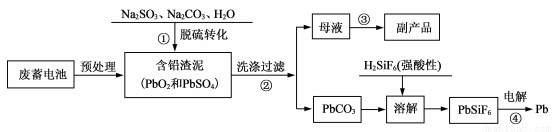
(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极反应式为__________,放电后该电极质量_______(填“增大”“减小”或“不变”)。
(2)步骤①中加入Na2SO3的作用是____________。
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法:_______________。
(4)若用NH4HCO3和NH3·H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理。如图是NH4 HCO3和NH3.H2O用量对含铅渣泥中脱硫率的影响:
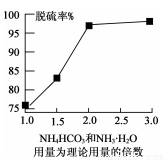
从图形可以看出,应选择NH4HCO3和NH3·H2O用量为理论用量的__________倍。该条件下步骤③从母液可获得副产品为_______________ 。
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是_________,阴极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com