
| A. | 加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+、 | |
| B. | 滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN- | |
| C. | 在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3- | |
| D. | 在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3- |
分析 A.加入铝粉只有氢气产生的溶液中存在大量氢离子或氢氧根离子,酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气,镁离子与氢氧根离子反应;
B.滴加石蕊试液显红色的溶液中存在大量氢离子,铁离子与硫氰根离子反应生成硫氰化铁;
C.五种离子之间不反应,都不与硫酸氢钠溶液反应;
D.铝离子、铁离子与碳酸氢钠溶液发生双水解反应.
解答 解:A.加入铝粉只有氢气产生的溶液呈酸性或碱性,NO3-在酸性条件下与铝反应不会生成氢气,Mg2+与氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故A错误;
B.Fe3+和 SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故B错误;
C.NH4+、Na+、Al3+、Cu2+、NO3-之间不发生反应,都不与NaHSO4反应,在溶液中能够大量共存,故C正确;
D.Al3+、Fe3+与NaHCO3发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:实验题
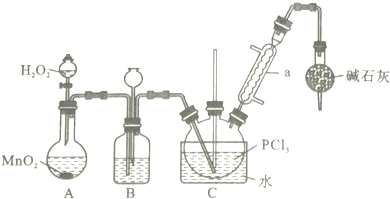
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
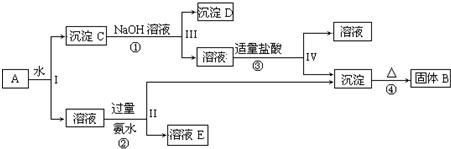
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
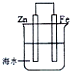
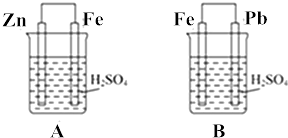
| A. | 此装置属于电解池 | |
| B. | 此装置中的铁做正极,发生氧化反应 | |
| C. | 此装置中电子从锌极流向铁极 | |
| D. | 此装置中的锌做阴极,极反应为:Zn-2e→Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将该Na2CO3 溶液转移至250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 | |
| B. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取150ml蒸馏水加入,搅拌 | |
| C. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取400ml蒸馏水加入,搅拌 | |
| D. | 将该Na2CO3 溶液转移至500ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
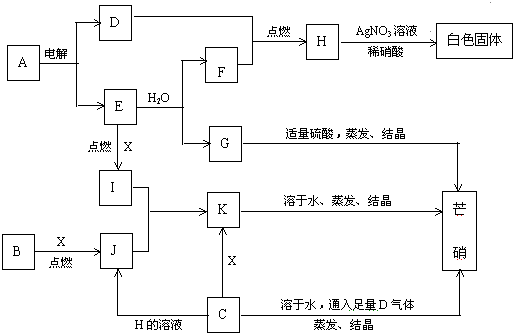
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
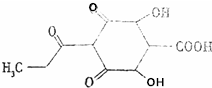 一种植物生长调节的结构简式如图所示,下列说法不正确的是( )
一种植物生长调节的结构简式如图所示,下列说法不正确的是( )| A. | 该物质含有3种官能团 | B. | 该物质属于脂环烃 | ||
| C. | 该物质属于多官能团化合物 | D. | 该物质属于烃的衍生物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com