���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�
��1����һ������ĺ����ܱ������У��������»�ѧ��Ӧ��N
2��g��+3H
2��g��

2NH
3��g��
�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/K |
298 |
398 |
498 |
�� |
| K/��mol?L-1��2 |
4.1��106 |
K1 |
K2 |
�� |
����������⣺
�ٱȽ�K
1��K
2�Ĵ�С��K
1��
��
K
2�����������=����������
���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������
AC
AC
������ţ���
A��2v��H
2��������=3v��NH
3�����棩 B��v��N
2��������=3v��H
2�����棩
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��2�������£�N
2H
6Cl
2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH
4Cl���ƣ�
��д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ
N
2H
62++H
2O

[N
2H
5?H
2O]
++H
+N
2H
62++H
2O

[N
2H
5?H
2O]
++H
+��
��������ˮ��Һ������Ũ�ȵ�����˳����ȷ����
A
A
������ţ���
A��c��Cl
-����c��N
2H
62+����c��H
+����c��OH
-��
B��c��Cl
-����c��[N
2H
5?H
2O
+]����c��H
+����c��OH
-��
C��c��N
2H
62+��+c��[N
2H
5?H
2O
+]��+c��H
+��=c��Cl
-��+c��OH
-��
D��c��N
2H
62+����c��Cl
-����c��H
+����c��OH
-��
��ˮ�����ؽ���Ǧ����Ⱦ���ⱸ�ܹ�ע�������ϵ�֪Pb
4+���к�ǿ�������ԣ�ˮ��Ǧ�Ĵ�����̬��Ҫ��Pb
2+��Pb��OH��
+��Pb��OH��
2����ˮ���ܽ��С����Pb��OH��
3-��Pb��OH��
42-������̬�����ʵ����ķ���������ҺpH�仯�Ĺ�ϵ����ͼ��ʾ��
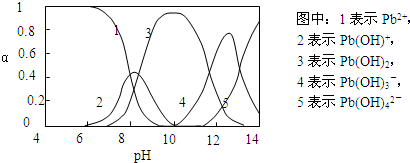
��1��Pb��NO
3��
2��Һ�У�c��Pb
2+��/c��NO
3-��
��
��
1/2�����������=��������������
��2����Pb��NO
3��
2��Һ�μ����ᣬ��Һ��c��Pb
2+��/c��NO
3-��û�б������С���г������ɣ������ɵij�������Ϊ
PbCl2
PbCl2
��
��3����Pb��NO
3��
2��Һ�еμ�NaOH��Һ����ҺҲ����ǣ���pHԼΪ
10
10
ʱ���ɳ�����࣬�����μ�NaOH��Һ�������ϵ������壮pH=13ʱ�������ϵ�з�������Ҫ��Ӧ�����ӷ���ʽΪ��
Pb��OH��3-+OH-=Pb��OH��42-
Pb��OH��3-+OH-=Pb��OH��42-
��

 CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O�� CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O�� 4NO+6H2O��
4NO+6H2O�� 4NO+6H2O��
4NO+6H2O��


 2NH3��g��
2NH3��g�� [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+
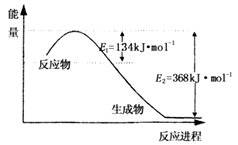
 2N2O5(g)����֪��ϵ��n(NO2)��ʱ��仯���±���
2N2O5(g)����֪��ϵ��n(NO2)��ʱ��仯���±��� 
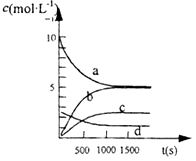
 2NH3(g)�ﵽ��ѧƽ��״̬�����ݵ���___________���������ĸ����
2NH3(g)�ﵽ��ѧƽ��״̬�����ݵ���___________���������ĸ����