
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;
由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应;
(2)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
(3)据Qc和K的关系确定平衡的建立方向;令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO2的物质的量,进而计算CO2的浓度变化量,利用v=$\frac{△c}{△t}$计算v(CO2);
(4)Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,还生成KCl,同时生成水,结合元素的化合价变化计算转移电子数.
解答 解:(1)反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)的平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$,由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;<;
(2)A.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故错误;
B.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故正确;
C.加入合适的催化剂,平衡不移动,故错误;
D.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故错误;
故选B;
(3)令平衡时CO2的物质的量变化为nmol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以$\frac{n+1}{1-n}$=4,解得n=0.6,开始Qc=1<4=K,所以反应正向进行建立平衡,
所以v(CO2)=$\frac{\frac{0.6mol}{10L}}{10min}$mol•L-1•min-1=0.006 mol•L-1•min-1,
故答案为:>;0.006 mol•L-1•min-1;
(4)Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,还生成KCl,同时生成水,该反应为2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,其中反应的氧化剂是KClO,由Fe元素的化合价变化可知,生成2molK2FeO4转移的电子的物质的量为6mol,生成0.5mol K2FeO4转移电子的物质的量是1.5mol
故答案为:KClO;1.5.
点评 本题考查化学平衡的有关计算、化学反应速率计算、平衡常数等,难度中等,注意掌握化学平衡常数的应用:1、用来判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、用来计算物质的转化率.


科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 明矾 | 食盐 | 石墨 | 醋酸 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| D | KOH | CuSO4 | Na2SO4 | NaClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
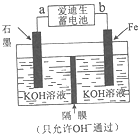 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
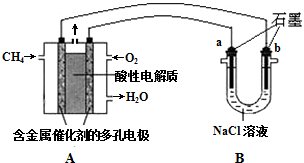
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
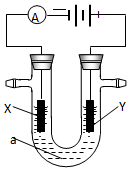 ( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com