
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是______(填物质化学式)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
(2)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O、Ag2O+H2O+2e-=2Ag+2OH-,电池的正极是____________,负极发生的是____________反应(填“氧化”或“还原”)。
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇(CH3OH)燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为________
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”)
【答案】PbO2 3.5 Ag2O 氧化 甲醇 从左到右
【解析】
(1)放电时铅失电子而作负极,PbO2为正极得到电子发生还原反应,生成硫酸铅难溶于水,负极反应为:Pb-2e-+SO42-=PbSO4 ,正极反应为:PbO2+2e-+4H++2SO42-═PbSO4+2H2O,根据硫酸和转移电子之间的关系式计算。
(2)正极得到电子发生还原反应,负极放电时失电子,发生氧化反应。
(3)①由图可知,质子向正极移动,c通入氧气,b通入甲醇。
②电子经外电路由负极流向正极。
(1)放电时的总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅失电子化合价升高而作负极,PbO2作正极得到电子发生还原反应,生成硫酸铅难溶于水,该电极质量增加,原电池中:负极反应:Pb-2e-+SO42-═PbSO4 ,正极反应:PbO2+2e-+4H++2SO42-═PbSO4+2H2O,根据硫酸和转移电子之间的关系式得,转移电子的物质的量3mol,消耗硫酸物质的量3mol,最后硫酸溶液浓度=(2L×5mol·L-1-3mol)/2L=3.5mol·L-1。
(2)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O、Ag2O+H2O+2e-=2Ag+2OH-,正极得到电子发生还原反应,电池的正极是Ag2O,负极放电时失电子,还原剂被氧化,发生氧化反应。
(3)①由氢离子移动方向知,右侧电极为正极,c口通氧气,左侧电极为负极,b口通入燃料甲醇。
②电子经外电路由负极流向正极,该电池工作时,电子的流向为从左到右。


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(CB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
I.定性实验方案如下:
(1))利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因是:___________。
II.定量实验方案如下(部分装置和操作略):

(2)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为________________。
(3)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定,除去H2O2的方法是_______。
(4)步骤X滴定至终点时,消耗NaOH溶液30.00mL,该葡萄酒中SO2的含量为_____g/L。该测定结果比实际值偏高,分析原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是广泛存在于植物中的一类芳香化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和和化合物E。
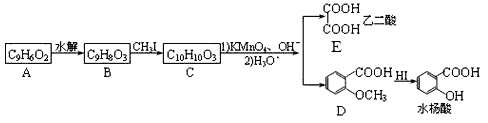
已知:CH3CH = CHCH2CH3![]() CH3COOH + CH3CH2COOH
CH3COOH + CH3CH2COOH
请回答下列问题:
(1)C中官能团的名称为________;化合物A的结构简式为________。
(2)C生成D和E的反应类型为________,化合物E的化学名称是________。
(3)写出B→C的化学反应方程式_________ 。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的二元取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有________种;写出其中核磁共振氢谱有4种峰,且其信号强度之比为1:2:2:3的一种同分异构体的结构简式________ 。
(5)已知: R- CH=CH2![]() R-CH2CH2Br,请设计合理方案由
R-CH2CH2Br,请设计合理方案由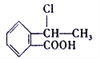 合成
合成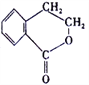 (其他无机原料自选,用反应流程图表示,并注明反应条件)。_______。示例:原料
(其他无机原料自选,用反应流程图表示,并注明反应条件)。_______。示例:原料![]() ……产物
……产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶波中加入铝粉能产生氢气,则该溶液中不可能大量共存的一组离子是
A. K+、Cl-、H+ B. NH4+、NO3-、SO42- C. K+、A13+、Br- D. Na+、K+、SiO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若N60与C60结构相似的另一种“足球分子”,则下列说法正确的是
A. N60分子中只含有共价键 B. N60和14N都是氮的同位素
C. N60是一种新型化合物 D. N60与C60互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阳极的电极反应式________;
(3)某课题组用上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净。洗涤沉淀的操作是________。
②反应①的离子方程式为______________________。
③如下图,氧化还原滴定法测定制得的Ce(OH)4产品纯度。
![]()
该产品中Ce(OH)4的质量分数为________________(保留两位有效数字)。若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度__________ (“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片放入盛有过量稀硫酸的试管中,不影响氢气产生速率的因素是( )
A. 硫酸的浓度B. 铁片的表面积
C. 溶液的温度D. 加少量Na2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关加热操作正确的是( )
A.将烧杯放置在铁架台的铁圈上,直接用酒精灯火焰加热
B.将试管直接用酒精灯火焰加热
C.将蒸发皿放置在铁架台的铁圈上,并垫石棉网加热
D.将烧瓶放置在铁架台的铁圈上,直接用酒精灯火焰加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的化合物在生产、生活中广泛存在。
(1)我国长征系列运载火箭用肼(N2H4)作燃料。N2H4与NH3有相似的化学性质。
①写出肼与盐酸反应的离子方程式:_______________________________。
②在火箭推进器中装有液态肼和双氧水,当它们混合时迅速反应生成氮气和水蒸气,写出反应的化学方程式:_____________________________________。
③火箭发射时以肼为燃料,也可以用一氧化氮作氧化剂,反应过程中若转移2mol电子则消耗燃料肼的质量为______________。
(2)汽车尾气中的氮氧化物是形成酸雨、酸雾的有毒气体之一,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。

写出净化过程中总反应的化学方程式____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com