
【题目】国际计量大会新修订了阿伏加德罗常数(NA=6.02214076×1023mol1),并于2019年5月20日正式生效。下列有关NA说法正确的是
A.22.4LCH2=CHCH3分子中含碳碳双键的数目为NA
B.1mol羟基(﹣OH)所含的电子总数为9NA
C.常温常压下,14g聚乙烯含有原子总数为3NA
D.64 g S2和S8混合物中含硫原子总数为NA
科目:高中化学 来源: 题型:
【题目】碱式氯化铝是某种高效净水剂的主要成分,实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3、SiO2等杂质)制取碱式氯化铝的过程如下:

(1)溶解铝土矿需要使用质量分数为15%的盐酸,配制该盐酸所需的玻璃仪器有________
(2)盐酸溶解铝土矿的过程中,发生反应的离子方程式为____________(写一个即可),其目的是__________________________________________________________。
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为__________(填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,________________________________________________,得出被测液的pH。
(5)实验室利用盐酸与大理石制取CO2的实验装置如图所示:

则各装置中导管从左到右的连接顺序为_________,装置C中盛放的试剂X为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(2)碳酸氢钠溶液蒸干并灼烧得到的固体物质是__________(填化学式)。
(3)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_____________。
(4)将AgCl分别放入①5 mL H2O ②10 mL 0.2 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液④40 mL 0.1 mol·L-1 HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是______(用序号填空)。
(5)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合:若c(K+)<c (CH3COO-),则a_____________b(填>、<、=)。
(6)室温下,1 mol/L相同体积的下列四种溶液:①KCl②FeCl3③HF④Na2CO3中,所含阳离子数由少到多的顺序是_________________________(用序号填空)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法不正确的是( )
![]()
A. 它的核磁共振氢谱有8组吸收峰
B. 它的分子中所有的碳原子不可能在同一平面上
C. 它和丁基苯(![]() )互为同分异构体
)互为同分异构体
D. 一定条件下,它可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①盐酸;②二氧化碳;③高锰酸钾;④铝;⑤自来水;⑥石墨;⑦液氧;⑧淀粉;⑨纯碱
(1)以上物质能导电的是_______________
(2)以上物质属于电解质的是___________
(3)以上物质属于非电解质的是_________
(4)从上述物质选出一种或几种进行反应,写出既是氧化还原反应,又是化合反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加成反应是有机化学中的一类重要的反应,下列属于加成反应的是( )
A.CH3Cl+Cl2![]() CH2Cl2+HCl
CH2Cl2+HCl
B.CH4+2O2![]() CO2+2H2O
CO2+2H2O
C.CH2=CH2+H2O![]() CH3—CH2OH
CH3—CH2OH
D.![]() +Br2
+Br2![]() HBr+
HBr+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,在海洋循环中,通过下图所示的途径固碳。以下选项中相关说法不正确的是( )
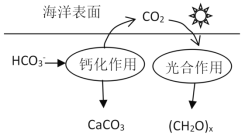
A.NaHCO3溶液中存在:c(H2CO3)+c(HCO3- )+c(OH-)=c(H+)
B.钙化作用的离子方程式为Ca2+ +2HCO3- ═CaCO3↓+CO2↑ + H2O
C.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+)
D.若将标况下2.24 L CO2气体通入足量的NaOH溶液,所得溶液中存在:n(H2CO3)+n(HCO3- )+n(CO32-)=0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化镁纯品为无色单斜晶体,工业品通常呈黄褐色,有苦咸味。该物质可以形成六水合物,即六水氯化镁(MgCl2·6H2O),以下流程为由某混合物,制取纯净MgCl2·6H2O的生产过程:
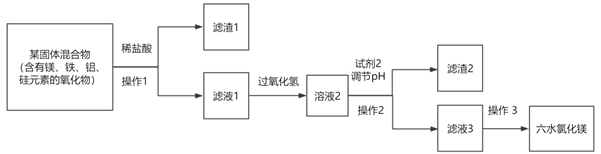
已知:在本流程中,
Fe3+ | Fe2+ | Al3+ | Mg2+ | |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.4 |
完全沉淀pH | 4.1 | 9.7 | 5.5 | 10.9 |
试回答下列问题:
(1)操作1所需玻璃仪器为____________________。
(2)流程中加入试剂2调节pH的范围是________;加入试剂2能形成沉淀的原因是___________________。
(3)操作3为加入足量的盐酸,然后经过___________、____________,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为____________________。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,则其饱 和溶液的pH=_________。(已知:lg5=0.7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com