
| A. | 元素Q的最高价氧化物对应的水化物酸性比W的强 | |
| B. | 化合物W2Q2中,各原子最外层均达8电子结构 | |
| C. | 工业上通过电解Z与Q形成的化合物制备Z单质 | |
| D. | Y单质与X的气态氢化物可发生置换反应 |
分析 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化,则Q只能为氯元素,据此解答.
解答 解:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化,则Q只能为氯元素.
A.非金属性Q(Cl)>W(S),故Cl元素最高价氧化物对应水化物的酸性更强,故A正确;
B.化合物S2Cl2中,S原子之间形成1对共用电子对、S原子与Cl之间形成1对共用电子对,各原子最外层均达8电子结构,故B正确;
C.Z与Q形成的化合物为AlCl3,属于共价化合物,不导电,工业上电解熔融的氧化铝制备Al单质,故C错误;
D.氧气能与氨气反应得到氮气、水,属于置换反应,故D正确,
故选C.
点评 本题结构位置性质关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物性质,D选项为易错点,注意利用氧化还原反应理解,难度中等.


科目:高中化学 来源: 题型:选择题
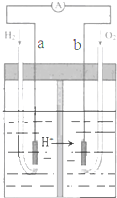
| A. | a极为负极,电子由a极流向b极 | |
| B. | a极的电极反应式是:H2-2e-=2H+ | |
| C. | 电池工作一段时间后,装置中c(H2SO4)增大 | |
| D. | 若将H2改为等物质的量CH4,O2的用量增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
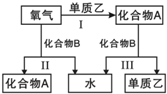 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题: ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 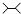 的名称为2,3-二甲基丁烷 的名称为2,3-二甲基丁烷 | |
| B. | 等质量的甲醛、乙酸、葡萄糖完全燃烧耗氧量相等 | |
| C. | 在一定条件下,使煤和氢气作用,可以得到液体燃料 | |
| D. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
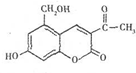
| A. | 亮菌甲素分子式为C12H11O5,属于稠环芳香烃 | |
| B. | 亮菌甲素具有弱酸性,说明羟基对苯环有影响 | |
| C. | 1mol亮菌甲素最多能与2molNaOH发生反应 | |
| D. | 1mol亮菌甲素最多能与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙原子的最外层有5个电子,其氢化物含有极性键 | |
| B. | 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强 | |
| C. | 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物完全反应形成的盐的溶液显酸性 | |
| D. | 乙、丙两元素形成的氢化物稳定性丙的强于乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
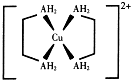 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com