
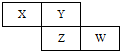
 (2010?宣武区二模)X、Y、Z、W四种短周期元素在周期表中的位置关系如图
(2010?宣武区二模)X、Y、Z、W四种短周期元素在周期表中的位置关系如图
| ||
| ||


| 高温、高压 |
| 催化剂 |
| 高温、高压 |
| 催化剂 |
| 28mol |
| 7×2 |
| ||
| ||
 ,工业合成氨气的化学方程式为N2+3H2
,工业合成氨气的化学方程式为N2+3H2| 高温、高压 |
| 催化剂 |
 ;N2+3H2
;N2+3H2| 高温、高压 |
| 催化剂 |
| 0.4mol |
| 6-4 |
| 0.4mol |
| 4-0 |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
 (2010?宣武区二模)向25.00mL 0.1000mol/L NaOH溶液中逐滴加入0.1000mol/L CH3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是( )
(2010?宣武区二模)向25.00mL 0.1000mol/L NaOH溶液中逐滴加入0.1000mol/L CH3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com