
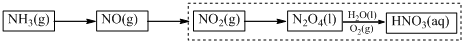
分析 (1)对于有气体参加的反应,增大压强正逆反应速率都加快;
(2)①NaClO溶液和NH3发生氧化还原反应生成氯化钠和肼,根据反应物和生成物写出反应方程式;
②电离方程式为N2H4+H2O?N2H5++OH-,根据K=$\frac{c({N}_{2}{{H}_{5}}^{+})×c(O{H}^{-})}{c({N}_{2}{H}_{4})}$计算;
③根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(3)根据反应2N2O4+2H2O+O2=4HNO3,提高了N2O4的浓度,根据浓度对化学平衡移动的影响分析.
解答 解:(1)对于有气体参加的反应,增大压强正逆反应速率都加快,所以增大压强逆反应速率加快,故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O?N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=$\frac{c({N}_{2}{{H}_{5}}^{+})×c(O{H}^{-})}{c({N}_{2}{H}_{4})}$=$\frac{{c}^{2}(O{H}^{-})}{0.01}$=1.0×10-6,所以c(OH-)=10-4mol/L,则c(H+)=10-10mol/L,则溶液的pH=10;
故答案为:10;
③32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(3)2N2O4+2H2O+O2=4HNO3,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
点评 本题考查了化学平衡的有关计算、电离常数及其计算工艺流程图的分析应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和b.
和b.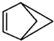 .请回答下列问题:
.请回答下列问题: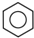 结构在下列哪些方面不同D(填字母代号).
结构在下列哪些方面不同D(填字母代号).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
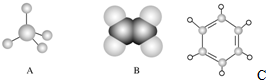 如图中A、B、C分别是三种有机物的结构模型:
如图中A、B、C分别是三种有机物的结构模型: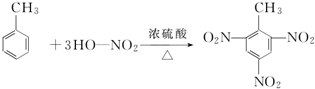 +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
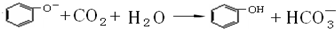 ,该反应说明苯酚具有的性质是弱酸性.
,该反应说明苯酚具有的性质是弱酸性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然橡胶、聚氯乙烯的链节中均含有两种官能团 | |
| B. | 氯气易液化,可用钢瓶储存液氯 | |
| C. | 工业酒精的浓度通常为95% | |
| D. | 向某溶液加入CCl4,若CCl4层显橙红色,证明原溶液中存在Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
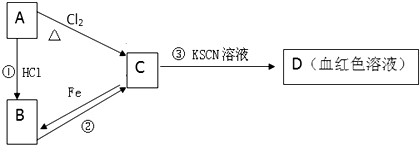
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 用盐酸酸化的高锰酸钾溶液区别苯与甲苯 | |
| C. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com