
已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)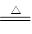 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
(共8分)(1)H 、S(各1分) (2)1mol (3)2mol 、64g(每空2分)
解析试题分析:(1)反应①中硫酸中氢元素的化合价解得,所以H元素被还原,反应②中硫酸中S元素的化合价降低,所以S元素被还原。
(2)2g氢气的物质的量是1mol,则消耗稀硫酸的物质的量是1mol。
(3)硫酸中S元素的化合价从+6价降低到+4价,得到2个电子,所以反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为2mol。若有4mol H2SO4参加反应时,被还原的硫酸是2mol,所以被还原元素的质量是2mol×32g/mol=64g。
考点:考查氧化还原反应的有关判断、应用以及计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练。有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力。该题的关键是明确氧化还原反应有关概念,准确标出有关元素的化合价变化情况,然后根据电子得失守恒并结合题意灵活运用即可。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:阅读理解
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是查看答案和解析>>
科目:高中化学 来源: 题型:

 -OOCCH3
-OOCCH3 -OOCCH3
-OOCCH3





查看答案和解析>>
科目:高中化学 来源: 题型:

 -OOCCH3
-OOCCH3 -OOCCH3
-OOCCH3





查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| 时间(min) | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.120 | 0.220 | 0.080 | 0.080 |
| 3 | 0.080 | 0.180 | 0.120 | 0.120 |
| 4 | 0.100 | 0.200 | 0.100 | C1 |
| 5 | 0.067 | 0.267 | 0.133 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com