
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下所示(部分反应条件及产物略去):
![]()
![]()
![]()
![]()
![]()

(1)若A是一种淡黄色固体单质,则C与H2O反应的生成物为______(填化学式)。
(2)若C是一种淡黄色固体化合物,则C与CO2反应的化学方程式______________________________。
(3)若A可由图所示装置制得,且B、C均为会污染空气的气体,请写出A转化成B的化学方程式:________________________________________________________________________。
【答案】H2SO4 2Na2O2+2CO2=2Na2CO3+O2 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
(1)若A是淡黄色固体单质,则A是S,硫在氧气中燃烧生成SO2,则B是SO2,在一定条件下,二氧化硫被氧气氧化生成SO3,所以C是SO3;
(2)若C是一种淡黄色固体化合物,B被氧气氧化生成C,则C是Na2O2,B是Na2O,A是Na;
(3)若A可由图所示装置制得,则A是NH3,B、C均为会污染空气的气体,所以B是NO,C是NO2,结合物质的性质分析解答。
(1)通过以上分析知,C是SO3,三氧化硫和水反应生成硫酸,化学式为H2SO4,
故答案为:H2SO4;
(2)通过以上分析知,C是Na2O2,Na2O2与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)通过以上分析知,A是NH3,氨气发生催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。


科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:
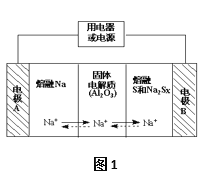

(1)根据表数据,请你判断该电池工作的适宜应控制
在_____(填字母)范围内。
A.100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(2)放电时,电极A为_____极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:________________。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
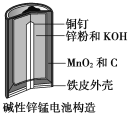
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。
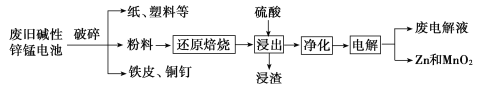
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图所示:
回答下列问题:
(1)MnOOH中,Mn元素的化合价为_________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有_________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。常温下,已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol/L,根据下列数据计算,调节pH的合理范围是______至__________。(离子浓度小于1×10-5 mol/L即为沉淀完全)
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_________。本工艺中应循环利用的物质是_______(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,且生成一种黄绿色气体,“粉料”中的MnOOH与盐酸反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
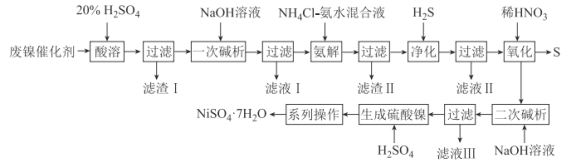
已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________。
(2)“滤渣Ⅰ”的主要成分为__(填化学式),该物质在工业上的用途为_________(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________。
(4)“氨解”发生反应的离子方程式为________。“净化”时通入H2S的目的是_______。
(5)“氧化”时发生反应的化学方程式为_________。
(6)“系列操作”具体是指_________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置示意图如图所示。下列有关该原电池的说法正确的是
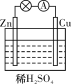
A. 锌片是正极
B. 溶液中H+由铜电极移向锌电极
C. 铜片上有气泡产生
D. 电子由铜电极经导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。
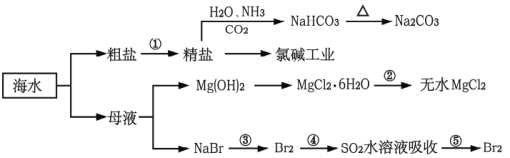
下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟悉和使用中学化学实验中常见仪器及用品是化学学习的基本要求。试回答以下问题:
(1)温度计、量筒、滴定管的一部分如图所示,下列读数(虚线所指刻度)及说法正确的是________(填字母代号)。

A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.①是温度计,读数为2.5 ℃
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有________(填字母代号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管f.碱式滴定管
(3)实验室常见的几种气体发生装置如图A、B、C所示:
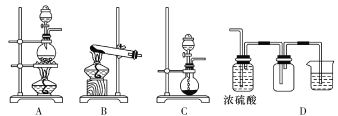
检查装置C气密性的操作方法是________________________。 若用装置A与装置D相连制取、收集气体X,则X可能是下列气体中的________(填数字序号)。
①CO2 ②NO ③Cl2 ④H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温度和压强。已知b > 3a,且燃烧后气体体积缩小了b/16mL,则乙烯的体积为( )
A.b/16mL B.b/8mL C.(a- b/8) mL D.(a+ b/8) mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.工业制造漂白粉的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2
![]() +H2O
+H2O
C.将少量碳酸氢铵溶液滴入NaOH溶液反应的离子方程式:NH4++HCO3-+2OH-=NH3↑+CO32+2H2O
D.CuCl2的水解方程式:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com