
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力 | |
| D. | 光纤通信是现代化的通信手段,光导纤维的主要成分是晶体硅 |
分析 A.油脂是高级脂肪酸跟甘油生成的酯,其中形成油脂的脂肪酸的饱和程度对油脂的熔点有着重要的影响,由饱和的脂肪酸生成的甘油酯熔点较高;
B.蛋白质中含有C、O、H、S、P等;
C.生铁中的Fe、C和电解质溶液易形成原电池,发生电化学腐蚀;
D.光导纤维的主要成分是二氧化硅晶体.
解答 解:A.油脂是高级脂肪酸跟甘油生成的酯,其中形成油脂的脂肪酸的饱和程度对油脂的熔点有着重要的影响,由饱和的脂肪酸生成的甘油酯熔点较高,所以油脂饱和程度越大,熔点越高,故A正确;
B.丝、毛的主要成分是蛋白质,蛋白质中含有C、O、H、S、P等,在燃烧时不仅仅生成二氧化碳和水,故B错误;
C.生铁中的Fe、C和电解质溶液易形成原电池,发生电化学腐蚀,所以生铁比纯铁更易被腐蚀,故C错误;
D.光导纤维的主要成分是二氧化硅晶体,单质硅晶体用作半导体材料,故D错误;
故选:A.
点评 本题考查了物质的性质及用途,明确物质的性质决定其用途是解本题关键,难度不大,侧重于考查学生对基础知识的综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列叙述正确的是( )
下列叙述正确的是( )| A. | 青蒿酸分子能在NaOH溶液中发生水解反应 | |
| B. | 在一定条件下,香草醛分子最多有16个原子共面 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 用FeCl3溶液或NaHCO3溶液都可以鉴别香草醛和青蒿酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
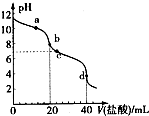 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )| A. | a点:c(CI-)>c(M+)>(OH-)>c(H+) | |
| B. | b点:MOH和HCl恰好完全反应 | |
| C. | c点:c(H+)=c(OH-)+c(MOH) | |
| D. | a点到d点:水电离的c(H+)•c(OH-)先变大,后变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z |
| R |
| A. | R的氧化物对应的水化物一定是强酸 | |
| B. | X、Y、Z三种元素既能形成共价化合物又能形成离子化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有2种 | |
| D. | Z、W形成的化合物中只能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
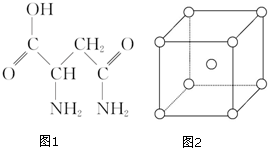 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com