
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:

已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
【答案】 羧基、羟基 ② HOCH2CH2OH+HOOC﹣COOH![]() 2H2O+
2H2O+![]()
![]()
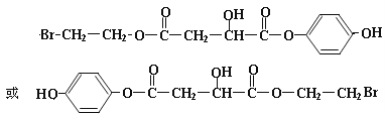 5mol 2种
5mol 2种 
【解析】D为X的水解产物,向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号,说明D含有苯环,且有两个对称结构,为-OH,D的结构应为:![]() ,由B+F→M(C4H4O4)可以知道B为HOCH2CH2OH,F为HOOC-COOH,M为
,由B+F→M(C4H4O4)可以知道B为HOCH2CH2OH,F为HOOC-COOH,M为![]() ,由X含有
,由X含有![]() 结构可以知道G为
结构可以知道G为![]() ,因
,因![]() ,且M、N互为同分异构体,N能使溴的四氯化碳溶液褪色,说明N中含有C=C键,其结构简式为HOOC-CH=CH-COOH,以此回答题中各问。
,且M、N互为同分异构体,N能使溴的四氯化碳溶液褪色,说明N中含有C=C键,其结构简式为HOOC-CH=CH-COOH,以此回答题中各问。
详解:(1)G的结构为![]() ,分子中含有羧基、羟基,因此,本题正确答案是:羧基、羟基;
,分子中含有羧基、羟基,因此,本题正确答案是:羧基、羟基;
(2)D的结构为![]() ,结构中含有苯环和酚羟基,在一定条件下能发生加成、取代和氧化反应,因此,本题正确答案是:②;
,结构中含有苯环和酚羟基,在一定条件下能发生加成、取代和氧化反应,因此,本题正确答案是:②;
(3)①醇和羧酸在浓硫酸和加热条件下可发生酯化反应,生成酯和水,①的反应为: HOCH2CH2OH+HOOC﹣COOH![]() 2H2O+
2H2O+![]() ,
,
因此,本题正确答案是: HOCH2CH2OH+HOOC﹣COOH![]() 2H2O+
2H2O+![]() ;
;
②在浓硫酸条件下,羟基邻位C原子上有H原子,在浓硫酸作用下可发生消去反应生成含C=C键的物质,②的反应为:![]() ,
,
因此,本题正确答案是:![]() ;
;
(4)X水解产物酸化后生成:![]() 、HOCH2CH2OH,和
、HOCH2CH2OH,和![]() ,则X的结构可能为:
,则X的结构可能为: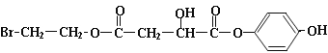 或
或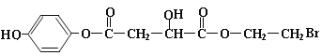 ,结构中含有1molBr,1mol酚羟基、2mol酯基,其中有1mol酯基水解生成1mol-COOH和1mol酚羟基,共消耗5molNaOH,
,结构中含有1molBr,1mol酚羟基、2mol酯基,其中有1mol酯基水解生成1mol-COOH和1mol酚羟基,共消耗5molNaOH,
因此,本题正确答案是: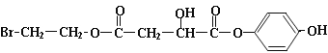 或
或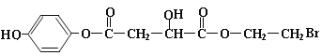 ;5mol;
;5mol;
(5)W与G互为同分异构体,分子式为C4H6O5,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基,则结构中含有1个羧基、1个醛基和2个羟基,分别连接在3个碳原子上,可能的结构有2种,为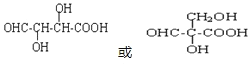 ,
,
因此,本题正确答案是:2种;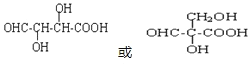 。
。


科目:高中化学 来源: 题型:
【题目】下列化学用语中,正确的是( )
A. 次氯酸的结构式:H—O—Cl
B. 氮气的电子式:∶N∶∶∶N∶
C. CO2分子的电子式:O=C=O
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。

(1)装置甲中仪器A的名称是________,丙中应装的溶液是_______ ,甲装置中发生反应的离子方程式为_____________ 。制取收集纯净氯气的装置接口连接顺序是a→ …→g(补充完整)_________。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是__________________;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?_____填“是”或“否” )。用0.10 molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图所示 ,其读数为 _____mL.

b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11
(3) 某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
![]()
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质;电解质中迁移介质是一种有机聚合物,其单体之一M结构简式如下图:

M的结构简式
电池反应为:LiC6+FePO4![]() LiFePO4+6C
LiFePO4+6C
下列说法正确的是
A.放电时,体系中的Li+向负极移动
B.放电时,FePO4作正极发生氧化反应
C.充电时,与电源正极相连的电极反应为:LiFePO4-e-==Li++FePO4
D.1 mol有机物M与足量NaOH溶液反应,消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下:

请回答下列问题:
(1)A的分子式为___________;这五种化合物中,互为同分异构体的是_________(填序号)。
(2)若E![]() X
X ![]() Y,且Y是D的同分异构体,写出反应①的化学方程式:__________________________,Y的结构简式为___________,反应③属于______反应。
Y,且Y是D的同分异构体,写出反应①的化学方程式:__________________________,Y的结构简式为___________,反应③属于______反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com