
| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 1:2 |
分析 发生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,以此来解答.
解答 解:反应为3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂对应还原产物,NO为还原产物,物质的量为1mol;还原剂对应氧化产物,硝酸为氧化产物,物质的量为2mol,所以氧化剂与还原剂物质的量之比为1:2,即发生还原反应和发生氧化反应的物质质量之比为1:2,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 12mol/L的盐酸 | B. | 10mL 18mol/L的硫酸 | ||
| C. | 80 mL 2mol/L的硫酸 | D. | 40 mL 14mol/L的硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
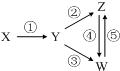 下列各组物质中,能一步实现如图所示①~⑤转化关系的是( )
下列各组物质中,能一步实现如图所示①~⑤转化关系的是( )| X | Y | Z | W | |
| A | Fe3O4 | Fe | FeCl2 | FeCl3 |
| B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W |  |
| A | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| B | Cl2 | Ca(ClO)2 | HClO | HCl | |
| C | Si | SiO2 | Na2SiO3 | H2SiO3 | |
| D | FeCl3 | FeCl2 | Fe(OH)2 | Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与银氨溶液反应析出银 | |
| D. | 与新制氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XYZW的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的最高价氧化物对应的水化物一定为强酸 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com