
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A._______;B.______;C.______;
D._______;E.______;F._______。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
E![]() B:______
B:______
C![]() F:______
F:______
【答案】Na NaOH Na2CO3 NaCl Na2O2 NaHCO3 2Na2O2+2H2O=4Na++4OH-+O2↑ CO32-+H2O+CO2=2HCO3-
【解析】
A与氧气反应生成淡黄色粉末E为Na2O2,则A为Na,钠与水反应生成B且也能由过氧化钠转化得到,可推知B为NaOH,由于NaOH与CO2得到C,C与CO2、H2O反应得到F,可推知C为Na2CO3、F为NaHCO3,碳酸钠与HCl反应得到固体D,且也能由过氧化钠转化得到D,可推知D为NaCl,据此解答。
根据上述分析可知:A为Na,B为NaOH,C为Na2CO3、D为NaCl,E为Na2O2,F为NaHCO3。
(1)由上述分析可知,A、B、C、D、E、F六种物质的化学式分别是A为Na,B为NaOH,C为Na2CO3、D为NaCl,E为Na2O2,F为NaHCO3。
(2) Na2O2与H2O反应产生NaOH和O2,所以E→B的反应是过氧化钠与水反应生成氢氧化钠与氧气,该反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
碳酸钠与二氧化碳、水反应生成碳酸氢钠,所以C→F反应离子方程式为:CO32-+H2O+CO2=2HCO3-。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.海带灰浸泡滤液中加入稀硫酸后再加入双氧水:2I-+ H2O2+4H+ = I2+2H2O
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.1L4mol·L-1 NaOH溶液中通入67.2LCO2(标准状况下),反应的离子方程式为:4OH- +3CO2 = 2HCO3-+CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家研发了可充电“全氢电池”,其工作原理如图所示,
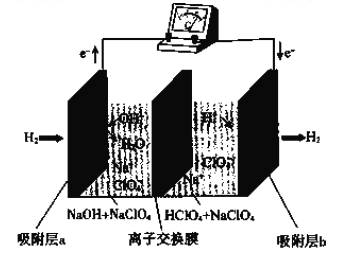
(1)吸附层a中发生反应的方程式是____________________________
(2)电池的总反应方程式是____________________________
(3)请在图中标出![]() 的移动方向 _______________________。
的移动方向 _______________________。
(4)下列说法正确的是_____________________________(选序号)。
a.![]() 可循环利用,基本不需要补充
可循环利用,基本不需要补充
b.![]() 的作用是传导离子和参与电极反应
的作用是传导离子和参与电极反应
c“全氢电池”工作时将化学能转化为电能
d.该电池充电时,吸附层b接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4.8gO3和0.2molCH4,在同温同压下的体积之比是__;相同质量的O2和SO2,所含分子的数目之比为__,所含O原子的物质的量之比为__,密度之比为__。
(2)标准状况下11.2 L N2所含分子数是___个。
(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是__g。
(4)483g Na2SO4·10H2O中所含的Na+的物质的量是__,SO42-的物质的量是__,所含H2O分子的数目是___个。
(5)现有100 ml 1.00 mol/L NaCl溶液,其中所含Na+的质量是___g。
(6)下列物质能导电是__,属于电解质是__,属于非电解质的是__。(填序号,多选或错选扣分)①水银 ②烧碱 ③硫酸钡 ④氯化钠晶体 ⑤盐酸 ⑥蔗糖
(7)实验室配制480mL0.08mol/LNa2CO3溶液,需要十水碳酸钠晶体质量_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为___,该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢硫酸是一种二元弱酸,请回答以下问题:
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2—)___c(H2S)(填“>”“<”或“=”)。
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是___(填字母)。
A. c(H+)·c(OH-)=1×10-14
B. c(Na+)=c(HS—)+2c(S2—)
C. c(Na+)> c(HS—)+c(S2—)+ c(H2S)
D. c(H2S)> c(S2—)
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) =___ (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ )___,原因是___(用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com