
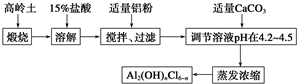
分析 加入盐酸,二氧化硅不反应,Al2O3、Fe2O3与盐酸反应生成氯化铝、氯化铁,加入适量铝粉,过滤,除去溶液中的铁离子,在滤液中加入适量碳酸钙调节pH在4.2~4.5,将溶液蒸发浓缩,可得到[Al2(OH)nCl6-n],以此解答该题.
解答 解:加入盐酸,二氧化硅不反应,Al2O3、Fe2O3与盐酸反应生成氯化铝、氯化铁,加入适量铝粉,过滤,除去溶液中的铁离子,在滤液中加入适量碳酸钙调节pH在4.2~4.5,将溶液蒸发浓缩,可得到[Al2(OH)nCl6-n],
(1)“溶解”过程反应的离子方程式有 Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(2)铝可与铁离子反应生成亚铁离子,铝与亚铁离子反应置换出铁,加入铝粉最主要作用是:除去溶液中的铁元素,故答案为:除去溶液中的铁元素;
(3)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝,防止生成氢氧化铝沉淀,实验时pH超过4.5,Al3+会形成Al(OH)3沉淀;pH低于4.2,Al3+水解程度很小,很难形成液态碱式氯化铝[Al2(OH)nCl6-n],
故答案为:pH超过4.5,Al3+会形成Al(OH)3沉淀;pH低于4.2,Al3+水解程度很小,很难形成液态碱式氯化铝[Al2(OH)nCl6-n];
(4)控制该温度在一定范围之间,可水浴加热,氯化铝水解生成Al2(OH)nCl6-n,反应的化学方程式为2AlCl3+nH2O═Al2(OH)nCl6-n+nHCl,
故答案为:水浴加热;2AlCl3+nH2O═Al2(OH)nCl6-n+nHCl.
点评 本题考查了物质制备方法和实验探究,为高频考点,掌握实验基本操作和理解实验原理是解题关键,题目难度中等,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Al3+、ClO-、Cl- | B. | Na+、NH4+、Cl- | C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
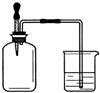 如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
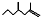 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),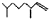 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )| A. | 以上三种信息素互为同系物 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同分异构体 | |
| D. | 家蚕的性信息素与1molBr2加成产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
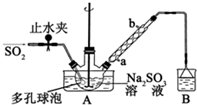 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
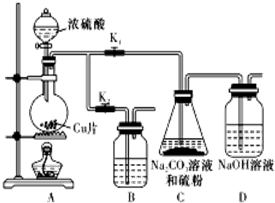 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol KClO3 参加反应有2mol电子转移 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | KClO3 在反应中得到电子,作氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com