
25℃时,关于指定溶液说法正确的是
A.pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2-
B.1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为NA
C.1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色
D.SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O
科目:高中化学 来源:2016-2017学年广西省高二上模拟考试化学卷(解析版) 题型:选择题
1 mol X能与足量碳酸氢钠溶液反应放出44.8 L CO2(标准状况),则X的分子式是
A. C5H10O4 B. C4H8O4 C. C3H6O4 D. C2H2O4
查看答案和解析>>
科目:高中化学 来源:2017届天津市五区县高三上学期期末考试化学试卷(解析版) 题型:填空题
磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
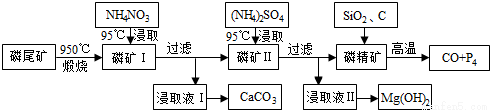
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1  HCOONa溶液,下列关系不正确的是____________。
HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO -)
-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减 小”或“不变”)。
小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届天津市五区县高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途说法不正确的是
A.FeCl3易溶于水,可用作净水剂
B.硅是半导体材料,纯净的硅是光纤制品的基本原料
C.浓硫酸能干燥氯气,说明浓硫酸具有吸水性
D.氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:实验题
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。已知:
①Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③Na2S2O3在20 ℃和70 ℃时的溶解度分别为60.0 g和212 g
Ⅰ 【制备产品】
实验装置如下图所示(省略夹持装置):
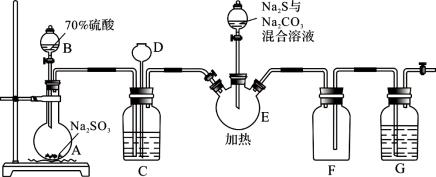
(1)仪器D的名称是 ;G中的试剂是 。
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ 【纯度检验】
取所得产品5.0 g,配成250 mL溶液。
(3)填写下表中的空白
实验方案 | 现象 | 结论 |
①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 |
| 产品中含Na2SO4 |
品红试纸不褪色 |
|
产品中形成Na2SO4的可能原因是 。
(4)取25.00 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00 mL。滴定终点的现象是 ,产品中的Na2S2O3·5H2O的纯度为 。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3·5H2O可通过 方法提纯。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:实验题
活性氧化锌是一种多功能性的新型材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
步骤II中,在酸性溶液中加入KMnO4的作用是将Fe2+ 氧化成Fe3+,离子方程式为 ;
(2)用ZnO调节pH,以除去含铁杂质。检验沉淀是否完全的实验操作是 ;调节pH的适宜范围是 。
(3)步骤III中加入Zn粉的作用是① ,②进一步调节溶液PH值。
(4)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
取1.000g活性氧化锌,用15.00mL 1.00mol/L硫酸溶液完全溶解,滴入几滴指示剂,再用0.50mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL,通过计算可以得到活性氧化锌的纯度,由表中Zn(OH)2PH变化可知,滴入的最理想的指示剂是 (填“酚酞”、“甲基橙”或“石蕊试剂”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(解析版) 题型:选择题
对室温下体积相同,浓度均为0.1 mol·L-1的盐酸和醋酸两种溶液分别采取下列措施。有关叙述一定正确的是
A.加水稀释100倍后,两溶液的pH相同
B.加入NaOH固体恰好中和后,两溶液的pH相同
C.分别加入足量锌粉充分反应,反应开始时两酸产生H2的反应速率相等
D.加人足量的小苏打固体充分反应后,两溶液中产生的CO2一样
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省定西市通渭县高二上学期期末化学试卷(解析版) 题型:填空题
现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增 大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比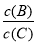 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入A(体积不变)时混合物的颜色________,加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一12月月考化学卷(解析版) 题型:选择题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体(已知:NH4++OH-=NH3↑+H2O),同时产生2.14g 红褐色沉淀;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的白色沉淀。由此可知原溶液中
A.至少存在4种离子
B.Cl-一定存在,且c(Cl-)≥0.4mol/L
C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com