
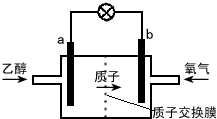
| A. | a极为电池的负极,该电极发生氧化反应 | |
| B. | 电池工作时电子由a极流出沿导线经灯泡到b极 | |
| C. | 电池正极的电极反应式为 O2+2H2O+4e-═4OH- | |
| D. | 电池工作时,1mol乙醇被氧化转移12mol电子 |
分析 由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合电极反应解答该题.
解答 解:A、原电池工作时,阳离子向正极移动,则b为正极,a为负极,乙醇在负极失电子发生氧化反应,故A正确;
B、原电池中电子从负极流向正极,则电子由a极流出沿导线经灯泡到b极,故B正确;
C.酸性条件下,氧气得电子生成水,所以电池工作时,正极的电极反应式为4H++O2+4e-=2H2O,故C错误;
D.电池工作时,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则1mol乙醇被氧化转移12mol电子,故D正确;
故选C.
点评 本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法以及原电池正极的判断.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③两步都是氧化还原反应 | B. | 只有第②步是氧化还原反应 | ||
| C. | 该方法对生产设备基本没有腐蚀 | D. | 该方法对环境污染较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| M |
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
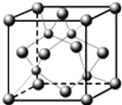 A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:r(Y2-)>r(Z2+) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物弱 | |
| D. | X、Y、Z、W所有元素的最高正价等于其所在族的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
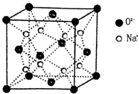 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ |
| 0.1mol•L-1CH3COOH溶液 | 0.01mol•L-1CH3COOH溶液 | pH=3的CH3COOH溶液 | 0.1mol•L-1NaOH溶液 | 0.1mol•L-1氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com