
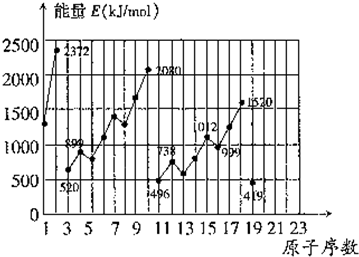
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示.

试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
(1)同主族内不同元素的E值变化的特点是________.各主族中E值勤的这种变化特点体现了元素性质的________变化规律.
(2)同周期同,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系中正确的是________
①E(砷)>E(硒);②E(砷)<E(硒);③E(溴)>E(硒);④E(溴)<E(硒)
(3)估计mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________.
(4)10号元素E值较大的原因是________.
上图提供了不同元素的气态原子失去最外层一个电子所需要的能量E值的变化曲线,要求考生通过对图表的阅读,根据元素在周期表中的位置,找出随着原子序数递增,气态原子失去最外层一个电子所需要的能量E值的变化规律,并回答问题.
(1)同主族不同元素的E值变化特点:以3,11,19号元素为例不难发现随着原子序数的增大,E值变小.同周期内随着原子序数的增加,E值逐渐增加.其中有些元素出现反常现象,但是同主族的元素,随着原子序数的增大,E值变小,且出现反常的元素在同一主族内.因此各主族E值的变化特点体现了元素性质的周期性变化规律.
(2)根据以上分析,判断第四周期元素砷、硒、溴E值的大小.第二周期的氮、氧和第三周期的磷、硫元素,E值均出现了反常现象;而第二周期的氧、氟,第三周期的硫、氯E值随着原子序数的增大而增大.因为,周期表中各元素E值的变化呈现出周期性,因此,E(砷)>E(硒)>E(溴).
(3)要估计1 mol气态Ca原子失去最外层一个电子需E值的范围,从第二主族的铍、镁元素的变化着手,E(铍)>E(镁).因此,E(镁)>E(钙),得出:E(镁)>E(钙)>E(钾).
说明10号元素E值较大的原因是:10号是氖,该元素原子的最外层电子排布已达8电子稳定结构,不易失去电子故E值大.
该题的内容教材中没有直接叙述,要求考生分析图中曲线特点,结合所学元素周期律知识,进行纵向、横向比较,从分析中做出预测、推断,实现文字、图表等信息的转换和加工处理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| E/eV | 13.4 | 24.6 | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 | 21.6 |
| 原子序数 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| E/eV | 5.1 | 7.6 | 6.0 | 8.1 | 11.0 | 10.4 | 13.0 | 15.8 | 4.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
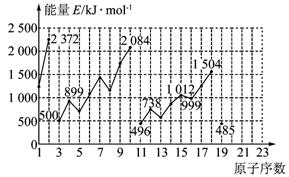
试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
(1)同主族内不同元素的E值变化的特点是______________________________。各主族中E值的这种变化特点体现了元素性质的_______________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是_______________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
_______________<E<_______________。
(4)10号元素E值较大的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
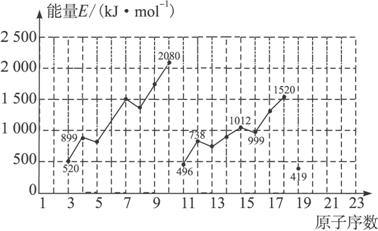
(1)同主族内不同元素的E值变化的特点是:________________________。各主族中E值的这种变化特点体现了元素性质的________________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是___________________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:__________<E<__________。
(4)10号元素E值较大的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题。

(1)同主族内不同元素的E值变化的特点是:__________________。各主族中E值的这种变化特点体现了元素性质的__________________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系式中正确的是_________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
__________________<E<__________________。
(4)10号元素E值较大的原因是_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com