
分析 (1)Ca的原子结构中电子层数等于周期数,最外层电子数等于族序数;
(2)先判断最活泼的非金属元素,再确定该化合物的化学式,根据电子式书写规则写出电子式;根据晶体类型判断沸点高低;
(3)根据得失电子数相等配平方程式;
(4)先判断Mn+离子是什么离子,再利用该离子的特殊反应检验;
(5)Cl-、SO42-均与硝酸银反应生成沉淀,Cl-用硝酸银检验,SO42-用硝酸钡检验,且先检验SO42-.
解答 解:(1)Ca是20号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,8,2,所以其原子结构示意图为 ,则位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族;
,则位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族;
(2)元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF2,
故答案为:CaF2;
(3)该方程式中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2P+5FeO+3CaO$\frac{\underline{\;高温\;}}{\;}$Ca3(PO4)2+5Fe,故答案为:2;5;3;1;5;
(4)根据题意知M(OH)n为请氧化铁,Mn+为Fe 3+,Fe 3+ 的检验方法是:向溶液中加入KSCN溶液后,溶液变成血红色就说明原溶液有Fe 3+,该反应的离子方程式为Fe+3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-═Fe(SCN)3;
(5)Cl-、SO42-均与硝酸银反应生成沉淀,Cl-用硝酸银检验,SO42-用硝酸钡检验,且先检验SO42-,则验证Cl-、SO42-的方法为先加Ba(NO3)2溶液,等沉淀后,再加AgNO3溶液,故答案为:C.
点评 本题考查金属及化合物性质及综合应用,为高频考点,把握原子结构与位置、氧化还原反应配平、离子检验等为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝需经过特别处理能具有抗腐蚀能力 | |
| B. | “地沟油”经过加工处理可用来制肥皂 | |
| C. | 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
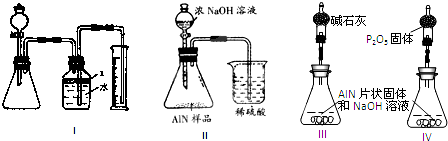
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
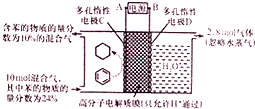 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
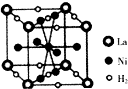 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 2.8g[CH2 CH2]n 中含有的碳原子数为0.2NA | |
| C. | 1mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
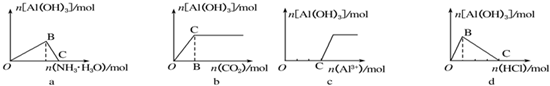
| A. | a① | B. | b② | C. | c④ | D. | d③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com