
| A. | 浓HNO3 | B. | NaHCO3 | C. | NH4Cl | D. | Fe(OH)3 |
分析 A.加热浓硝酸反应方程式为:4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O;
B.加热碳酸氢钠反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
C.加热氯化铵反应方程式为:NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑+NH3↑;
D.加热氢氧化铁固体反应方程式为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O.
解答 解:A.加热浓硝酸反应方程式为:4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,反应生成氧气,有单质生成,故A正确;
B.加热碳酸氢钠反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,无单质生成,故B错误;
C.加热氯化铵反应方程式为:NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑+NH3↑,无单质生成,故C错误;
D.加热氢氧化铁固体反应方程式为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,无单质生成,故D错误;
故选A.
点评 本题考查了物质的分解反应,明确物质分解时的生成物成分是解本题关键,根据方程式分析解答即可,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1 CaCl2溶液 | ||
| C. | 150mL2mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5p mol | B. | (3m+n/2)mol | C. | (3m+n)mol | D. | (3m+n/2-3 p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,BeCl2溶液的pH>7 | |
| B. | 常温时,Na2BeO2溶液的pH<7 | |
| C. | Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁、四氧化三铁、冰水混合物 | B. | 金属钙、氧化钙、石灰水 | ||
| C. | 水银、空气、干冰 | D. | 二氧化硫、水蒸气、天然气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
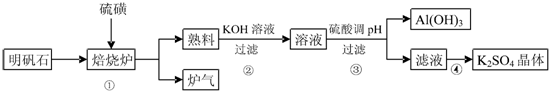
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷和丁烷 | B. | 乙烷和丙烷 | C. | 乙烷和丁烷 | D. | 戊烷和己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com