
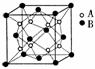
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为
A.CaF2 B.CaO2 C.CaC2 D.Na2O2
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是__________。C60和金刚石都是碳的同素异形体,二者相比较熔点较高的是__________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:__________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
据最近的美国《农业研究》杂志报道,美国的科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为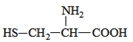 ,则下列说法错误的是
,则下列说法错误的是
A.两分子半胱氨酸脱水形成的二肽结构简式为:
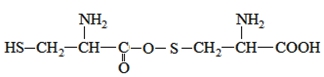
B.半胱氨酸是一种两性物质
C.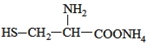 可与过量NaOH溶液反应放出氨气
可与过量NaOH溶液反应放出氨气
D.天然蛋白质水解产物均为α-氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线形的非极性分子
D.CH2==CH2分子中共有四个σ键和一个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
 请回答下列问题:
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiC Si; SiCl4 SiO2
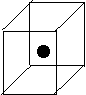
②右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体
的顶点用“●”表示出与之紧邻的硅原子。
③工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
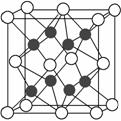 (2)化合物Na2O的晶胞如图。
(2)化合物Na2O的晶胞如图。
其中O2-离子的配位数为________,
该化合物与MgO相比,熔点较高的是________。(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为_____ ___g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
 |
实验操作步骤:
Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ. A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,
D中反应的化学方程式是________。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠 g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠-钾合金的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com