
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
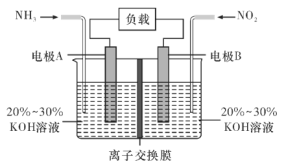
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
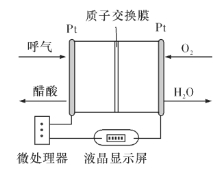
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:______________________________,负极反应方程式:____________________________。
【答案】右 左 阴 2NH3-6e-+6OH-=N2+6H2O 0.8mol C2H5OH+O2=CH3COOH+H2O C2H5OH+H2O-4e-=CH3COOH+4H+
【解析】
(1)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,放电时电流由正极经过导线流向负极;
(2)根据离子交换膜的作用分析判断;
(3)NH3在负极失电子的氧化反应,结合碱性条件、守恒思想写出电极反应式;
(4)正极上NO2发生得电子的还原反应,电极反应式为2NO2+8e-+4H2O=N2+8OH-,据此计算;
(5)由图2可知,酒精发生氧化反应生成醋酸,氧气得电子生成水,即酒精和氧气反应生成醋酸和水,所以左侧Pt电极为负极、右侧Pt电极为正极,据此写出总化学方程式和电极反应式。
由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极;
(1)原电池放电时,电流由正极经过导线流向负极,即电流由右侧电极经过负载后流向左侧电极;
(2)原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作;
(3)A电极为负极,发生失电子的氧化反应,反应式为电解质溶液呈碱性,则负极电极方程式为2NH3-6e-+6OH-=N2+6H2O;
(4)正极上NO2发生的电极反应式为2NO2+8e-+4H2O=N2+8OH-,即有2molNO2被处理时,转移电子8mol,所以有4.48LNO2(标准状况)即0.2molNO2被处理时,转移电子0.8mol;
(5)由图2可知,酒精和氧气反应生成醋酸和水,化学方程式为C2H5OH+O2=CH3COOH+H2O,酒精发生氧化反应生成醋酸,所以生成醋酸的Pt电极为负极,电极反应式为C2H5OH+H2O-4e-=CH3COOH+4H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验I:将Fe3+转化为Fe2+
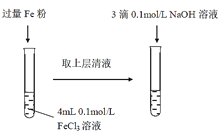
(1)常温下,FeCl3溶液显酸性,用离子方程式表示其显酸性的原因___。
(2)Fe3+与Fe粉发生反应的离子方程式为___。
(3)滴加NaOH溶液观察到的现象为___。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(4)用离子方程式解释NO产生的原因___。
(5)从化学反应限度的角度对体系中存在的反应进行反应I:Fe2+与HNO3反应;反应II:Fe2+与NO反应
①乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是___。
②查阅资料反应I的速率比反应II慢,请用化学平衡移动原理解释溶液由棕色变为黄色的原因___。
(6)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请画出实验装置图,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。___
Fe3+的转化,同时避免出现此异常现象。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链状有机物A是一种食用型香精,在一定条件下有如变化:

已知:(i) ![]()
(ii)A和G互为同分异构体,A不能使Br2的CCl4溶液褪色,B和F中所含官能团的类型相同。
完成下列填空:
(1)F的分子式为___________。CD的试剂和条件是________________。
(2)A的结构简式为_______________。 BH的反应类型是_____________。
(3)I中所有碳原子均在一条直线上,H转化为I的化学方程式为_______________。
(4)X是A的一种同分异构体,1 mol X 在HIO4加热条件下完全反应,可以生成1 mol无支链的有机物,则X的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:aA(g)+bB(g)![]() cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
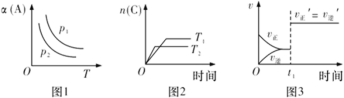
A.如图1反应:若p1>p2,则该反应只能在高温下自发进行
B.如图2反应:此反应的△H<0,且T1>T2
C.如图3反应:表示t1时刻可能是使用催化剂对反应速率的影响
D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔性屏手机开始崭露头脚。某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4 ![]() MnOOH+
MnOOH+![]() ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,正确的是
ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,正确的是

A.充电时,含有锌膜的碳纳米管纤维一端连接电源正极
B.放电时,电极的正极反应为:MnO2+e-+H+=MnOOH
C.充电时,Zn2+移向Zn膜
D.氢键是一种特殊的化学键,键能大于共价键,能使高聚物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物)。请填写下列空白:

(1)检验乙醛的试剂是_________;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为____________;
(3)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝?_____________,原因是_________;该实验中“鼓气速度”这一变量你认为可用______来估量;
(4)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是_______。以下实验需要水浴加热的是_________;(选填编号)
a.卤代烃水解 b.银镜反应 c. 乙酸丁酯 d.苯的硝化反应
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应)。该同学为解释上述现象,提出两种猜想:① 溴水将乙醛氧化为乙酸;② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A. NO2气体受压缩后,颜色先变深后变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C. 合成氨工业采用高温、高压工艺提高氨的产率
D. 配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸甲酯是一种治疗肠道疾病的药物,是由阿托酸(![]() )和甲醇反应制得。完成下列填空:
)和甲醇反应制得。完成下列填空:
(1)写出阿托酸甲酯的结构简式。_______________________________。
(2)工业上由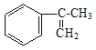 经过四步不同类型的反应制得阿托酸。请按实际进行的反应顺序写出指定反应步骤中所需要的试剂和反应条件:
经过四步不同类型的反应制得阿托酸。请按实际进行的反应顺序写出指定反应步骤中所需要的试剂和反应条件:
第一步________________________________; 第二步________________________________。
(3)写出第四步反应的化学方程式_______________________________________________。
(4)A是比 多两个碳原子的一种同系物,且A的所有碳原子可以处于同一平面上。写出A的结构简式________________________________。
多两个碳原子的一种同系物,且A的所有碳原子可以处于同一平面上。写出A的结构简式________________________________。
(5) ![]() 是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为_____________________________________。
是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子有机物P的合成路线如下:
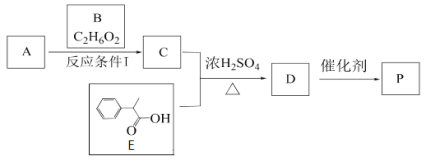
已知1 mol B与足量的金属钠反应产生标况下22.4L氢气
(1)A是2-甲基丙烯酸,A的结构简式是______________,E的化学式为___________________
(2)A和B生成C的反应类型是________,D生成P的反应类型是______________
(3)A与过量的B反应生成C,若A过量,则得到C′, C′的结构简式为__________________
(4)P用NaOH溶液处理,完全水解的化学方程式是:_________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com