
| 1000ρω |
| M |
| ||
| V+1 |
| V |
| Vm |
| m(溶质) |
| m(溶液) |
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 1000ρω |
| M |
| cM |
| 1000ρ |
| ||
| V+1 |
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
| ||
|
| 36.5V |
| 36.5V+22400 |
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
(
| ||
| 1000ρ g/L |
| 36.5V+22400 |
| 22400ρ |
| ||
|
| 1000ρV |
| 36.5V+22400 |


科目:高中化学 来源: 题型:阅读理解
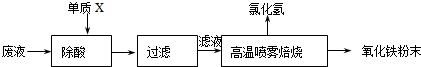
| ||
| ||
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, 加入足量的3mol?L-1H2SO4,充分振荡 加入足量的3mol?L-1H2SO4,充分振荡 |
样品全部溶解 样品全部溶解 |
| 步骤2. 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 |
试管中出现红色固体,说明试样中有CuO 试管中出现红色固体,说明试样中有CuO |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| VNA |
| n |
| VNA |
| 2000 |
| 20+9a |
| 2000 |
| 20+9a |
| b |
| 5.1 |
| b |
| 5.1 |
查看答案和解析>>
科目:高中化学 来源:北京市石景山区2010年高三一模(理科综合)化学部分 题型:选择题
下列说法正确的是 ( )
A.某温度时,pH=6的纯水,含10-6×6.02×1023个OH-
B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023
C.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5×6.02×1023
D.V L a mol/L的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知某氢氧化钠溶液V L中含有n个氢氧根离子,可求出此溶液的_______,是_______。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的___________,为________________。
(3)已知标准状况下氯化氢气体的溶解度为500,则可求出标准状况下氯化氢饱和溶液的_________________,为__________________。(设水在标准状况下的密度为1 g·cm-3)
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得白色固体b g,则可求出原氯化铝溶液的__________________,为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com