
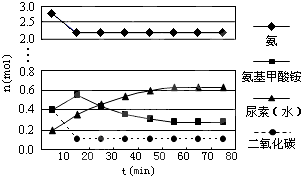
| 1mol-0.26mol |
| 0.5L |
| 0.148mol/L |
| 10min |
| 2x |
| a+b-2x |
| a+b |
| a+b-2x |
| 22x |
| 22x-2x |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
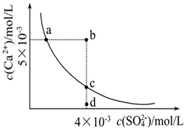 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说| A、常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中无沉淀析出 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C、d点溶液通过蒸发可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AgCl悬浊液中加入足量的NaI溶液,无明显现象 |
| B、CCl4和NH3两分子各原子最外层均满足8电子结构 |
| C、若短周期R2+和M+的电子层结构相同,则金属性R>M |
| D、硝酸铵溶于水吸热,是焓减熵增的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molSO2(g)和0.5molO2(g)置于密闭容器中 在一定条件下充分反应,放热98.3KJ |
| B、若升高温度,正反应速率增大,逆反应速率减小 |
| C、其他条件不变时,加入催化剂,速率一定加快 |
| D、2molSO2(g)和1molO2(g)具有的能量之和大于2molSO3(g)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,其溶液中没有Ag+和Clˉ |
| C、升高温度,AgCl沉淀的溶解度不变 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com