
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| C. | 0.5mol/LAlCl3溶液中Cl-的数目为2NA | |
| D. | 17g氨气中含有的电子数为10NA |
分析 A、求出镁的物质的量,然后根据反应后镁元素为+2价来分析;
B、标况下,四氯化碳为液态;
C、溶液体积不明确;
D、求出氨气的物质的量,然后根据氨气为10电子分子来分析.
解答 解:A、2.4g镁的物质的量为0.1mol,而反应后镁元素为+2价,故0.1mol镁失去0.2mol电子即0.2NA个,故A错误;
B、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、17g氨气的物质的量为1mol,而氨气为10电子分子,故1mol氨气中含10mol电子即10NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=16 | B. | K1=8 | C. | K2=1 | D. | K2=0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 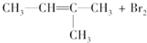 → → | |
| B. | CH2═CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH═CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | nCH2═CH2+nCH2═CH-CH3$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
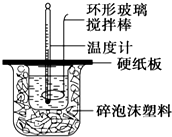 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g酒精和1g水混合后的总质量 | |
| B. | 100mL酒精与100mL水混合均匀后所得溶液的总体积 | |
| C. | 温度一定时1gH2O溶解1g硝酸钾后,所得溶液的质量 | |
| D. | 1g氢氧化钠溶液和1g醋酸溶液混合后溶液的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com