
¶ĢÖÜĘŚŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö¼Ó”£m”¢n”¢pŹĒÓÉÕāŠ©ŌŖĖŲ×é³ÉµÄ¶žŌŖ»ÆŗĻĪļ£¬W2”¢X2”¢Z2·Ö±šŹĒŌŖĖŲW”¢X”¢ZµÄµ„ÖŹ”£ŅŃÖŖ£ŗ
I£®Ņ»¶ØĢõ¼žĻĀijĆܱÕČŻĘ÷ÖŠæÉ·¢Éś·“Ó¦£ŗaX2+bW2 cm£¬·“Ó¦¹ż³ĢÖŠĪļÖŹµÄÅØ¶Č±ä»ÆČēĻĀ£ŗ
cm£¬·“Ó¦¹ż³ĢÖŠĪļÖŹµÄÅØ¶Č±ä»ÆČēĻĀ£ŗ
| X2 | W2 | m |
ĘšŹ¼ÅضČ/mol”¤L£1 | 0.4 | 0.4 | 0 |
Ę½ŗāÅضČ/mol”¤L£1 | 0.3 | 0.1 | 0.2 |
II£®ĖüĆĒæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ2m(g)+3Z(g)=6n(g)+X2(g)£»4n(g)+Y2(g) 2p(l)+2Z2(g)”£
2p(l)+2Z2(g)ӣ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®Ō×Ó°ė¾¶£ŗW£¼X£¼Y B£®a£ŗb£ŗc=3:1:2
C£®XµÄŃõ»ÆĪļŅ»¶ØŹĒĪŽÉ«ĘųĢå D£®m”¢n”¢pČżÖÖĪļÖŹ¾łĪŖ¹²¼Ū»ÆŗĻĪļ
 »īĮ¦æĪŹ±Ķ¬²½Į·Ļ°²įĻµĮŠ“š°ø
»īĮ¦æĪŹ±Ķ¬²½Į·Ļ°²įĻµĮŠ“š°ø ѧŅµ²āĘĄŅ»æĪŅ»²āĻµĮŠ“š°ø
ѧŅµ²āĘĄŅ»æĪŅ»²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ¹ć¶«ŹµŃé֊ѧĖ³µĀѧŠ£ø߶žÉĻ½×¶ĪÖŹ¼ģ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚ2A£«B 3C£«4D·“Ó¦ÖŠ
3C£«4D·“Ó¦ÖŠ £¬±ķŹ¾øĆ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ £Ø £©
£¬±ķŹ¾øĆ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ £Ø £©
A£®¦Ō£ØA£©£½ 0.5 mol/£ØL”¤£ó£© B£®¦Ō£ØB£©£½ 0.3 mol/£ØL”¤£ó£©
C£®¦Ō£ØC£©£½ 12 mol/£ØL”¤min£© D£®¦Ō£ØD£©£½ 6 mol/£ØL”¤min£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ°²»ÕŹ”ø߶žÉĻµŚŅ»“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŹĀŹµ£¬²»ÄÜÓĆĄÕĻÄĢŲĮŠŌĄķ½āŹĶµÄŹĒ
A£®ĻņĀČĖ®ÖŠ¼ÓČėAgNO3ČÜŅŗŗó£¬ČÜŅŗŃÕÉ«±äĒ³
B£®¶Ō2HI(g)  H2(g)+I2(g)Ę½ŗāĢåĻµ£¬Ģå»żĖõŠ”£¬Ń¹ĒæŌö“óæÉŹ¹ŃÕÉ«±äÉī
H2(g)+I2(g)Ę½ŗāĢåĻµ£¬Ģå»żĖõŠ”£¬Ń¹ĒæŌö“óæÉŹ¹ŃÕÉ«±äÉī
C£®ŗĻ³É°±·“Ó¦ÖŠÓĆ¹żĮæµŖĘųÓėĒāĘų·“Ó¦æÉŅŌĢįøßĒāĘųµÄ×Ŗ»ÆĀŹ
D£®½«»ģŗĻĘųÖŠµÄ°±ĘųŅŗ»Æŗó²»Ķ£µÄ·ÖĄė³öĄ“£¬ÓŠĄūÓŚŗĻ³É°±µÄ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½ĖÕŹ”ÄĻĶØŹŠČē¶«ĻŲŠģÖŻŹŠ·įĻŲøßČż10ŌĀĮŖæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÖø¶Ø·“Ó¦µÄĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ
A£®½«Ķ²åČėÅØĻõĖįÖŠ£ŗCu+4H++2NO3-£½Cu2++2NO2”ü+2H2O
B£®ĻņFeBr2ČÜŅŗÖŠĶØČė¹żĮæĀČĘų£ŗ2Fe2++Cl2£½2Fe3++2Cl-
C£®ĻņAl2O3ÖŠ¼ÓČė°±Ė®£ŗAl2O3+2OH-£½2 AlO2£+H2O
D£®Ģ¼ŗĶÅØĮņĖį¼ÓČČ£ŗC+2H++SO42££½H2O+ SO2”ü+ CO2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżĮŖŗĻæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
°±ŗĶĮŖ°±£ØN2H4£©¼ČŹĒŅ»ÖÖ¹¤ŅµŌĮĻ£¬ÓÖŹĒŅ»ÖÖÖŲŅŖµÄ¹¤Ņµ²śĘ·”£
£Ø1£©ŹµŃéŹŅæÉÓĆĀČ»Æļ§ÓėĻūŹÆ»Ņ·“Ó¦ÖĘČ”°±Ęų£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø2£©ĮŖ°±ŌŚŅ»¶ØĢõ¼žĻĀæÉ°“ĻĀŹ½·Ö”¾½āĪö”æ
3N2H4(g)=N2(g)+4NH3(g)£¬ŅŃÖŖ¶ĻĮŃ1molN”ŖH”¢N”ŖN¼°N”ŌNŠčĪüŹÕµÄÄÜĮæŅĄ“ĪĪŖ390.8kJ”¢193kJ”¢946kJ”£ČōÉś³É1molN2£¬Ōņ·“Ó¦ £ØĢī”°·Å³ö”±»ņ”°ĪüŹÕ”±£© kJµÄÄÜĮ攣
£Ø3£©NH3”ŖO2Č¼ĮĻµē³ŲµÄ½į¹¹ČēĶ¼ĖłŹ¾”£
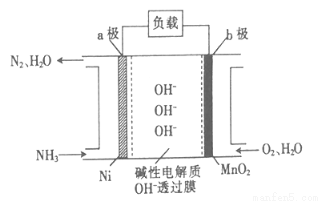
¢Ła¼«ĪŖµē³ŲµÄ £ØĢī”°Õż”±»ņ”°øŗ”±£©¼«”£
¢Śµ±Éś³É1molN2Ź±£¬µēĀ·ÖŠĮ÷¹żµē×ÓµÄĪļÖŹµÄĮæĪŖ ”£
£Ø4£©ĮŖ°±æÉŅŌøߊ§µŲĶŃ³żŃĢµĄĘųÖŠµÄNO“Ó¶ųÉś³ÉN2£¬øĆ·“Ó¦ÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżĮŖŗĻæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijŗŚÉ«·ŪÄ©ÓÉĮ½ÖÖĪļÖŹ×é³É£¬ĪŖ¼ų¶ØĘä³É·Ö½ųŠŠČēĻĀŹµŃé£ŗ
¢ŁČ”ÉŁĮæѳʷ¼ÓČė×ćĮæĄäµÄĻ”ĮņĖį£¬ÓŠĘųÅŻ²śÉś£¬¹ĢĢå²æ·ÖČܽā
¢ŚĮķȔɣĮæѳʷ¼ÓČė×ćĮæÅØŃĪĖį²¢¼ÓČČ£¬ÓŠĘųÅŻ²śÉś£¬¹ĢĢåČ«²æČܽā
øĆŗŚÉ«·ŪÄ©æÉÄÜĪŖ
A£®Fe”¢MnO2 B£®C”¢FeS C£®Si”¢FeO D£®CuO”¢Ag2S
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżĮŖŗĻæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
2016Äź8ŌĀ10ČÕ”¶ÉśĪļ¹Č”·ŌŲĪÄ³Ę£¬”°¶¾ŠŌĘųĢå”±CO”¢NO¼°H2SæÉ×÷ĪŖŠĀŠĶŅ©ĪļæŖ·¢µÄĒ±ŌŚ°Šµć£¬ÓĆŅŌæŖ·¢øü¶ąŠĀŠĶŅ©ĪļĄ“°ļÖśÖĪĮʶąÖÖČĖĄą¼²²””£ĻĀĮŠÓŠ¹ŲÕāČżÖÖĘųĢåµÄĖµ·ØÕżČ·µÄŹĒ

A£®¶¼ŹĒµē½āÖŹ B£®¶¼Ņ×ČÜÓŚĖ®
C£®¶¼ÄÜÓė¼īČÜŅŗ·“Ó¦ D£®¶¼ŹōÓŚ¹²¼Ū»ÆŗĻĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗÓÄĻŹ”øßČżÉĻµŚŅ»“ĪĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
øł¾Ż±ķ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø£©
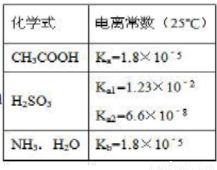
A£®25”ćCŹ±£¬pH=3µÄ“×ĖįŗĶpH=11µÄ°±Ė®µČĢå»ż»ģŗĻŗ󣬻ģŗĻŅŗÖŠĖ®µÄµēĄėŹĒ±»“Ł½ųµÄ
B£®Na2SO3ČÜŅŗÖŠµĪ¼Ó×ćĮæ“×Ėį£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗSO3 +2CH3COOH=SO2”ü+H2O+2CH3COO-
C£® NaHSO3ČÜŅŗ³ŹĖįŠŌ£¬ŹĒŅņĪŖKw/Ka1>Ka2
D£®0£®1mol/LµÄCH3COOHČÜŅŗÓėµČÅØ¶ČµČĢå»żµÄCH3COONa »ģŗĻŗó£¬ČÜŅŗÖŠµÄĪ¢Į£“ęŌŚŅŌĻĀ¹ŲĻµ£ŗ c (H+) +c (CH3C OOH) =c (CH3COO-
OOH) =c (CH3COO- ) +2c (OH-)
) +2c (OH-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | z=2 | B£® | 2sŗó£¬ČŻĘ÷ÄŚµÄŃ¹ĒæŹĒ³õŹ¼µÄ$\frac{7}{8}$±¶ | ||
| C£® | 2sŹ±CµÄĢå»ż·ÖŹżĪŖ$\frac{2}{7}$ | D£® | 2sŗó£¬BµÄÅضČĪŖ0.5mol/L |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com