
| A、铁表面镀锡成为马口铁,破损后,锡被腐蚀 | B、船底镶嵌锌块,锌作负极,以防船体被腐蚀 | C、铜锌原电池中的电子是从锌流向铜 | D、工业上电解饱和食盐水的阳极反应:2Cl--2e=Cl2↑ |


科目:高中化学 来源: 题型:
 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
| ||
| 充电 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:解答题
 Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.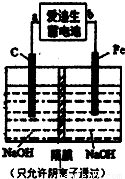
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com