
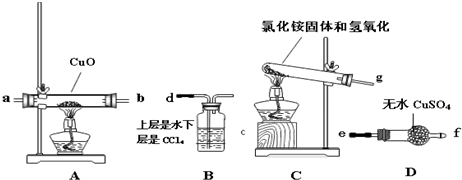
分析 (1)①氨气极易溶于水;
②固体氢氧化钠溶于水放热,电离产生氢氧根离子,结合一水合氨电离平衡移动影响因素;
③加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵;
④硝酸铵分解会得到氮的氧化物等杂质;
(2)实验室用氯化铵和消石灰反应制备氨气,反应生成氯化钙、氨气和水;
(3)C制备氨气,A装置中氨气与CuO反应,D装置检验氨气与CuO反应生成水,B装置进行尾气处理,并防止水蒸气加入D中;
(4)制备的氨气中含有水蒸气,加入A装置需要干燥,防止对D中水蒸气检验的影响;
(5)CuO全部变为红色物质,说明生成Cu,无水CuSO4变蓝,说明生成水,同时生成一种无污染的气体为氮气;
(6)B装置的用途为:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中;
(7)在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu与Cu2+.
解答 解:(1)①氨气极易溶于水,不适合制备氨气,故①错误;
②固体氢氧化钠溶于水放热,电离产生氢氧根离子,氢氧根离子浓度增大,抑制了氨气的电离,有利于氨气的逸出,故②正确;
③加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵,不能制得氨气,故③错误;
④硝酸铵分解会得到氮的氧化物等杂质,不适合制备氨气,故④错误.
故选:②;
(2)实验室用氯化铵和消石灰反应制备氨气,反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)C制备氨气,A装置中氨气与CuO反应,D装置检验氨气与CuO反应生成水,B装置进行尾气处理,并防止水蒸气加入D中,装置从左至右连接接口序号为:g→ab→ef→d,
故答案为:g→ab→ef→d;
(4)制备的氨气中含有水蒸气,加入A装置需要干燥,防止对D中水蒸气检验的影响,该装置的改进措施是:在装置C和A之间连接一个盛有碱石灰的干燥管,
故答案为:在装置C和A之间连接一个盛有碱石灰的干燥管;
(5)CuO全部变为红色物质,说明生成Cu,无水CuSO4变蓝,说明生成水,同时生成一种无污染的气体为氮气,反应方程式为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O,
故答案为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;
(6)B装置的用途为:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中,
故答案为:吸收尾气,防止倒吸;隔绝空气,防止空气中水蒸气进入D中;
(7)在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu与Cu2+,检验该红色物质中是否含有Cu2O的实验方案为:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有,
故答案为:取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有.
点评 本题物质性质探究实验方案,关键是对实验原理的理解,试题有利于培养学生的分析、理解能力及化学实验能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
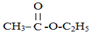 相关物质间转化关系如图:
相关物质间转化关系如图:
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$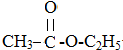 +H2O
+H2O

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:CH3COOH | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | Cl-的结构示意图: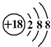 | D. | 乙烯的结构简式CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com