
科目:高中化学 来源: 题型:阅读理解
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省部分重点中学高二秋季期中联考化学试卷(带解析) 题型:实验题
(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区七校高二上学期期中考试化学试卷(解析版) 题型:选择题
某学生实验仪器的选择及数据记录,都合理的是( )
A.酸碱中和滴定时,用10mL量筒量取10.00mL待测液
B.用托盘天平称量25.20gNaCl固体
C.常温条件下,用广泛pH试纸测得纯水的pH为7.0
D.用500mL容量瓶配制480mL0.100mol/LNaOH溶液
查看答案和解析>>
科目:高中化学 来源:2011-2012年广东省汕头市高一上学期期中考试化学试卷 题型:实验题
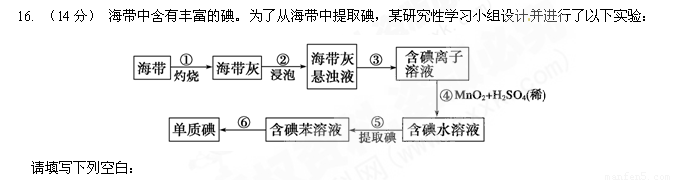 (1)步骤③的实验操作名称是 ;步骤⑤所用实验仪器的名称是
;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(1)步骤③的实验操作名称是 ;步骤⑤所用实验仪器的名称是
;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(2)步骤④反应的离子方程式是2I-+MnO2+4H+ = Mn2++I2+2H2O,该反应的氧化剂是 ,每生成0.5mol I2转移的电子的物质的量为 。
(3)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com