
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )

A.相同条件下产生气体的体积:V甲=V乙
B.溶液pH值变化:甲减小乙增大
C.溶液的质量变化:甲减小乙增大
D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:Mg - 2e—= Mg2+
C
【解析】
试题分析:甲是电解池,乙是原电池。对于甲,在阳极发生反应4OH—-4e-= O2↑+2H2O当电路中通过的电子是0.1mol时,产生气体0.025mol.对于乙:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若转移电子0.1mol,则产生气体的物质的量为0.05mol,因此相同条件下产生气体的体积V甲<V乙。错误。B.对于甲,反应的总方程式为:2CuSO4+2H2O 2Cu+ O2↑+2H2SO4,随着电解的进行,溶液的酸性增强,所以溶液pH值减小;对于乙,反应的总方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑随着电解的进行,溶液的碱性减弱,所以溶液pH值减小。错误。C.根据电解的总方程式可知:两个装置中溶液的质量变化:甲减小乙增大。正确。D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:2Al - 6e—+8OH-= 2AlO2-++3H2↑+4H2O。错误。
2Cu+ O2↑+2H2SO4,随着电解的进行,溶液的酸性增强,所以溶液pH值减小;对于乙,反应的总方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑随着电解的进行,溶液的碱性减弱,所以溶液pH值减小。错误。C.根据电解的总方程式可知:两个装置中溶液的质量变化:甲减小乙增大。正确。D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:2Al - 6e—+8OH-= 2AlO2-++3H2↑+4H2O。错误。
考点:考查原电池、电解池的反应原理及应用的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的数值,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属
B.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
C.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L
D.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:填空题
【选修3:物质结构与性质】(10分)
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
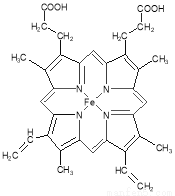
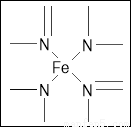
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g) △H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的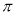 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式 ,1 mol O22+中含有的π键数目为 。
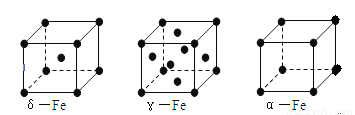
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)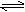 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:简答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。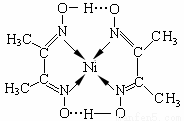
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
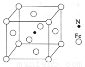
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。
B.绿色化学的核心是从源头上消除工业生产对环境的污染。
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-) 填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1 氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:实验题
乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取它用冰醋酸14.3 mL、95%乙醇 23 mL。还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要装置如图所示:

实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里冰醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135 ℃~145℃
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是__________ _______。
(2)用过量乙醇的主要目的是________ _________。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是________ ___。
如果用NaOH溶液代替Na2CO3溶液将引起的后果___________________________________。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____ ______。
(5)在步骤⑧所得的粗酯里还含有的杂质是______ ___。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| C-O | C=O | C≡O |
CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N |
N2 | 154.8 | 418.4 | 941.7 |
CO与N2中化学性质较活泼的是 ;结合数据说明原因 。
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN- 形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是 。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3- 互为等电子体的分子 (写出一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com