
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;分析 (1)同周期自左而右金属性减弱,同主族自上而下金属性增强,结合金属活动顺序表判断Na与Ca的金属性强弱;
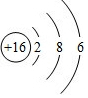
(2)S原子核外有16个电子层,由里到外各层电子数为2、8、6;
(3)非金属性越强,最高价氧化物对应水化物的酸性越强;
(4)同周期随原子序数增大,原子半径减小;
(5)同周期自左而右非金属性增强,非金属性越强,其氢化物越稳定;
(6)硅的氧化物是二氧化硅;常用于制造光导纤维;
(7)氮原子最外层为5个电子,易与氢原子形成3对共用电子对;二氧化氮溶于水,反应中NO2氧化剂又是还原剂.
解答 解:(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故短周期中Na的金属性最强,在金属活动顺序表中Ca排在Na的前边,故Ca的金属性比Na强,故上述元素中Ca的金属性最强,
故答案为:钙;
(2))S原子核外有16个电子层,由里到外各层电子数为2、8、6,原子结构示意图为: ,
,
故答案为: ;
;
(3)同周期自左而右元素非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,故第三周期元素最高价含氧酸中HClO4的酸性最强,
故答案为:HClO4;
(4)同周期自左而右原子半径减小,故原子半径:O<N<C,
故答案为:O<N<C;
(5)同周期自左而右非金属性增强,故第三周期中Cl的非金属性最强,非金属性越强,其氢化物越稳定,故HCl最稳定,
故答案为:HCl;
(6)硅的氧化物是二氧化硅,化学式为SiO2;常用于制造光导纤维,
故答案为:SiO2;光导纤维;
(7)氮原子最外层为5个电子,易与氢原子形成3对共用电子对形成稳定结构,所以其氢化物为:NH3;二氧化氮与水的反应NO2中N的化合价为+4价,生成物中NO中N元素的化合价为+2价,HNO3中N元素的化合价为+5价,方程式为2NO2+H2O=2HNO3+NO,
故答案为:NH3;3NO2+H2O═2HNO3+NO;
点评 本题考查了元素周期律和元素周期表的综合应用,熟悉元素周期律是解本题关键,结合原子结构、物质的性质来分析解答,知道原子结构示意图书写、元素周期律的内涵,总结归纳基础知识,灵活运用知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 中子数为3的He原子:32He | B. | HCl的电子式: | ||
| C. | S2-的结构示意图: | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.60 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
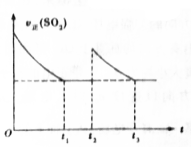 一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )
一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )| A. | t2时改变的条件是:只加入一定量的SO2 | |
| B. | t1时平衡常数K1大于t3时平衡常数K2 | |
| C. | t1时平衡混合气的$\overline{{M}_{1}}$大于t3时平衡混合气的$\overline{{M}_{2}}$ | |
| D. | t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
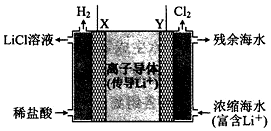 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12O6(葡萄糖aq)+6O2$\stackrel{酶}{→}$6CO2+6H2O | |
| B. | CH3COOH+KOH═CH3COOK+H2O | |
| C. | A+B═C+D;△H<0 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com