
| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
分析 A.甲苯与溴水不反应;
B.苯酚在水中的溶解度不大,苯酚易溶于酒精;
C.在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解得到银氨溶液;
D.用银氨溶液或新制氢氧化铜来检验醛,均与酮不反应;
E.硫酸铜与NaOH反应生成氢氧化铜,且碱过量.
解答 解:A.甲苯与溴水不反应,甲苯能被高锰酸钾氧化,故A不选;
B.苯酚在水中的溶解度不大,苯酚易溶于酒精,则不慎把苯酚溶液沾到了皮肤上,应立即用酒精擦拭,故B不选;
C.在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解得到银氨溶液,不能将浓氨水一次性加入,故C不选;
D.用银氨溶液或新制氢氧化铜来检验醛,均与酮不反应,银镜反应需要水浴加热,与氢氧化铜加热煮沸,故D不选;
E.硫酸铜与NaOH反应生成氢氧化铜,且碱过量,则可配制氢氧化铜悬浊液,故E选;
故选E.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的性质、反应等,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有的原子数为NA | |
| B. | 常温常压下,8g甲烷中含有的电子数为5NA | |
| C. | 22 g CO2 与标准状况下11.2 L O2含有相同分子数 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
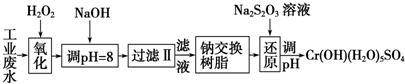
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 过氧化氢的电子式: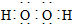 | |
| C. | 氧原子的价电子排布图: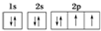 | |
| D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
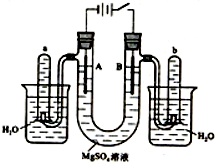 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 锂在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为2NA | |
| D. | 常温常压下,17克NH3中含有共价键的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com