C
分析:A.质量换算物质的量,结合质子数计算分析;
B.根据物质的量与转移电子之间的关系判断,1molNa
2O
2与水完全反应时转移电子数为N
A;
C.NH
4+发生水解,NH
4+浓度越小水解程度越大,NH
4+浓度越大,水解程度越小,所以溶液中NH
4+数目取决于溶液体积与NH
4+的浓度;
D.苯分子中的碳碳键是完全等同的特殊化学键,不是双键.
解答:A.在常温常压下,17 g硫化氢的物质的量为:n=

=
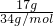
=0.5mol,1个氢原子含有1个质子,1个硫原子含有16个质子,所以1molH
2S含有18mol质子,0.5mol硫化氢所含质子数目,9 N
A,故A错误;
B.2Na
2O
2+2H
2O=4NaOH+O
2 ↑反应中O元素化合价由-1价降低为-2价,由-1升高为0价,Na
2O
2既是氧化剂又是还原剂,各占

,1molNa
2O
2完全反应转移电子物质的量为1mol×2×

=1mol,转移电子数目为:1mol×N
Amol
-1=1N
A,故B错误;
C.NH
4+发生水解,NH
4+浓度越小水解程度越大,NH
4+浓度越大,水解程度越小,所以溶液中NH
4+数目前者大于后者,故C正确;
D.苯分子中的碳碳键是介于碳碳双键和碳碳单键之间的一种特殊的化学键,是完全等同的特殊化学键,不是双键,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,掌握盐类水解的应用、氧化还原反应电子转移的计算、苯的结构等知识是解答的关键,题目难度不大.

 =
=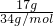 =0.5mol,1个氢原子含有1个质子,1个硫原子含有16个质子,所以1molH2S含有18mol质子,0.5mol硫化氢所含质子数目,9 NA,故A错误;
=0.5mol,1个氢原子含有1个质子,1个硫原子含有16个质子,所以1molH2S含有18mol质子,0.5mol硫化氢所含质子数目,9 NA,故A错误; ,1molNa2O2完全反应转移电子物质的量为1mol×2×
,1molNa2O2完全反应转移电子物质的量为1mol×2× =1mol,转移电子数目为:1mol×NAmol-1=1NA,故B错误;
=1mol,转移电子数目为:1mol×NAmol-1=1NA,故B错误;

 名校课堂系列答案
名校课堂系列答案