
分析 (1)根据NO的性质可知,NO易与氧气结合,氮的氧化物易形成酸雨,可破坏臭氧层,易与人体血红蛋白结合;
(2)一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是二氧化碳和氮气.
解答 解:(1)NO能与臭氧反应而破坏臭氧层,因NO易与氧气结合,氮的氧化物、二氧化硫是形成酸雨的成分,所以NO易形成酸雨,与人体血红蛋白结合,则A、C、D正确,高温下能氧化金属,但常温下不氧化金属,所以常温下不对环境产生危害,所以B不正确,
故答案为:ACD;
(2)由题意可知反应物是CO和NO,即反应物中含有C、N、O三种元素,生成物中也必须只能含有C、N、O三种元素,“三效催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒混合气体,所以该反应为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故A正确,
故选A.
点评 本题考查氮的氧化物的性质及其对环境的影响,题目难度不大,注意把握相关基础知识,易错点为(1).


科目:高中化学 来源: 题型:解答题
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
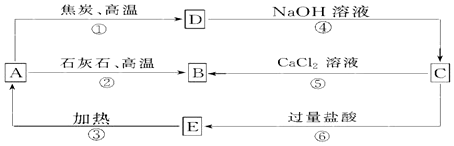
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
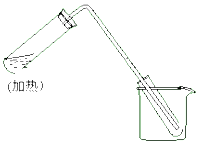 如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +nCH3OH$→_{△}^{浓H_{2}SO_{4}}$
+nCH3OH$→_{△}^{浓H_{2}SO_{4}}$ +2nH2O.
+2nH2O. $?_{△}^{催化剂}$
$?_{△}^{催化剂}$ +2nCH3OH.
+2nCH3OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com