

分析 (1)黄铜矿废渣焙烧生成二氧化硫、氧化铁与CuO;
(2)氧化铁、氧化铜、二氧化硅混合物用硫酸溶解,二氧化硅不反应,过滤除去;
(3)硫酸铜、硫酸铁滤液中加入Fe除去硫酸铜,过滤分离,滤液中加入硫酸、过氧化氢得到聚铁,滤渣B中含有Cu及Fe,利用磁石分离出Fe;
(4)双氧水不稳定,温度过高容易分解;
(5)二氧化硫转化制备的硫酸及滤渣B中的Fe可以循环利用;
(6)根据电子转移守恒计算过氧化氢的质量,再结合双氧水的密度与质量分数计算.
解答 解:(1)黄铜矿废渣焙烧生成二氧化硫、氧化铁与CuO,反应方程式为:4FeCuS2+13O2$\frac{\underline{\;焙烧\;}}{\;}$8SO2+2Fe2O3+4CuO,
故答案为:4FeCuS2+13O2$\frac{\underline{\;焙烧\;}}{\;}$8SO2+2Fe2O3+4CuO;
(2)氧化铁、氧化铜、二氧化硅混合物用硫酸溶解,二氧化硅不反应,过滤除去,滤渣A的主要成分为:SiO2,
故答案为:SiO2;
(3)硫酸铜、硫酸铁滤液中加入Fe除去硫酸铜,过滤分离,滤液中加入硫酸、过氧化氢得到聚铁,滤渣B中含有Cu及Fe,利用磁铁吸附分离出Fe,
故答案为:Fe;磁铁吸附;
(4)控制温度不能过高,其原因是:温度过高,双氧水会分解,工业上此过程应在反应釜中进行,
故答案为:温度过高,双氧水会分解;B;
(5)二氧化硫转化制备的硫酸及滤渣B中的Fe可以循环利用,
故答案为:Fe、H2SO4;
(6)聚铁中Fe为+3价,根据电子转移守恒,当生成1mol聚铁时消耗H2O2为$\frac{2mol×(3-2)}{2}$=1mol,故需要30%H2O2(密度为1.11g/cm3)的体积为:1mol×34g/mol÷30%÷1.11g/cm3=102.1cm3,
故答案为:102.1.
点评 本题考查物质制备工艺流程,涉及对原理与操作的分析评价、条件控制、物质的分离提纯、氧化还原反应计算等,熟练掌握元素化合物性质,是对学生综合能力的考查.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
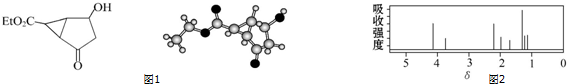
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
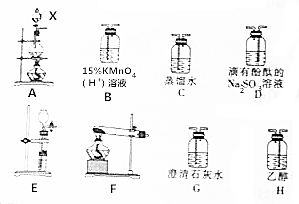 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com