
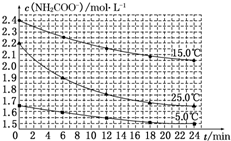
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
分析 (1)①根据化学平衡的标志来判断;
②先根据反应 NH2COONH4(s)?2NH3(g)+CO2(g).可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2 的平衡浓度,最后代入平衡常数的表达式来计算;
③根据压强对化学平衡的影响判断平衡移动的方向从而判断氨基甲酸铵固体的质量的变化情况;
④根据表中数据判断随着温度升高,平衡移动的方向,从而判断出正反应是吸热还是放热;根据气态物质的熵大于液态物质的熵判断出熵变;
(2)⑤根据化学反应速率的公式来计算;
⑥由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明.
解答 解:(1)①A.因未指明速率的方向,无法确定正逆反应速率的关系,故A错误;
B.该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C.该反应是气体质量增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故C正确;
D.因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3,故D错误;
故选:BC;
②容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为$\frac{2}{3}$c总、$\frac{1}{3}$c总,代入平衡常数表达式:
K=c2(NH3)•c(CO2)=($\frac{2}{3}$c总)2($\frac{1}{3}$c总)=$\frac{4}{27}$×(4.8×10-3 )3 =1.6×10-8,故答案为:1.6×10-8;
③压缩容器体积,气体压强增大,平衡向逆向移动,氨基甲酸铵质量增加,故答案为:增加;
④从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;反应中固体变为气体,混乱度增大,△S>0,
故答案为:>;>;
(2)⑤化学反应速率V=$\frac{△C}{△t}$=$\frac{(2.2-1.9)mol•{L}^{-1}}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
⑥因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
点评 本题是一道考查化学反应速率概念及其计算,化学平衡、化学平衡常数的概念及其计算,以及判断反应的焓变、熵变等相关知识的试题,要求考生利用图表、进行数据分析判断,吸收、提取有效信息,突出了化学信息运用能力的考查.同时,对于作为化学的基本技能之一的化学计算,渗透在相关的知识块之中,强调计算的实用性以及认识、解决问题的综合性.


科目:高中化学 来源: 题型:解答题
 ,用电子式表示X与R化合物的形成过程
,用电子式表示X与R化合物的形成过程
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
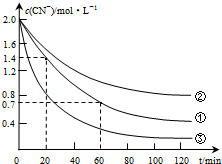 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| 分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH 4 | B. | C 2H 4 | C. | C 2H 6O | D. | C 6H 12O 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 | |
| C. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com