

| A. | c为阴极,d为阳极 | B. | 氯离子往d电极移动 | ||
| C. | 该装置能将化学能转化为电能 | D. | d的电极反应式为:Cu2++2e-═Cu |
分析 在电解池中,电流的流向和电子的移动方向相反,根据电子或电流的流向可以确定电解池的阴阳极,进而确定电极反应.
解答 解:在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A、c是阳极,d是阴极,故A错误;
B、电解过程中,氯离子在阳极c上失电子产生氯气,氯离子浓度减小,所以氯离子往c电极移动,故B错误;
C、该装置能将电能转化为化学能,故C错误;
D、电解过程中,d电极是阴极,该电极上铜离子得电子析出金属铜,电极质量增加,所以电极反应式为:Cu2++2e-═Cu,故D正确.
故选D.
点评 本题考查电解池的工作原理,难度不大,会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,再根据所学知识进行回答.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | B. | 氯化氢的电子式: | ||
| C. | 镁的原子结构示意图: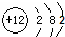 | D. | 水的电离方程式:H2O═H++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、NH4+、Cl-、HS- | |
| B. | Na2CO3溶液中:K+、NH4+、SO42-、Cl- | |
| C. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的水溶液中:Ca2+、HCO3-、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 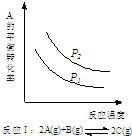 反应:△H>0,P2>P1 | B. | 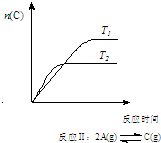 反应:△H<0,T1<T2 | ||
| C. | 反应:△H>0,T2>T1;或△H<0,T2<T1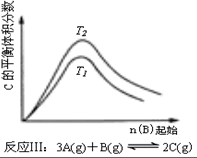 | D. | 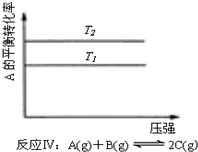 反应:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
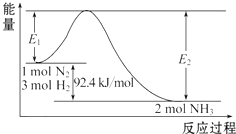 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 植物油不能使溴的四氯化碳溶液褪色 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
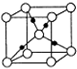 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 硝酸与金属反应时,只表现出氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com