
| A. | H2S | B. | NH3 | C. | CH2Br2 | D. | BF3 |
分析 根据价层电子对互斥理论判断,价层电子对数等于σ键+孤电子对;HCHO中C原子成2个C-H键、1个C=O双键,杂化轨道数为3,C原子采取sp2杂化,O原子成1个C=O双键,含有2对孤电子对,杂化轨道数为3,O原子采取sp2杂化,甲醛分子中心原子为C原子,不含孤电子对,分子构型为平面三角形,利用价层电子对互斥理论结合各选项进行分析.
解答 解:HCHO中C原子成2个C-H键、1个C=O双键,中心原子为C原子,价层电子对个数=3+$\frac{1}{2}$(4-2×1-1×2)=3,且不含孤电子对,中心原子杂化方式为sp2,分子空间构型为平面三角形.
A.H2S分子中S原子价层电子对个数是4且含有2个孤电子对,所以S原子采用sp3杂化,为V形结构,故A错误;
B.氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以中心原子杂化方式是sp3、分子空间构型为三角锥形,故B错误;
C.CH2Br2分子中的C原子价层电子对个数是4,则C原子采取sp3杂化,分子构型为四面体形,故C错误;
D.BF3分子中B原子价层电子对个数是3且不含孤电子对,所以B原子采用sp2杂化,分子空间构型是平面三角形,故D正确;
故选D.
点评 本题考查杂化轨道、分子空间构型等,题目难度中等,注意理解杂化轨道理论与价层电子对互斥理论,进行分子构型的判断.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | Cl2的摩尔质量是71 g/mol | |
| C. | 标准状况下,22.4 L H2O的物质的量为1 mol | |
| D. | 1 mol H2的质量是1 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
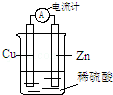
| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
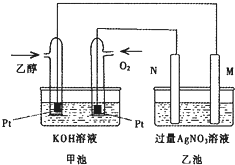 如图是个乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料分别是石墨和铁工作时M、N两个电极的质量都不减少,请回答:
如图是个乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料分别是石墨和铁工作时M、N两个电极的质量都不减少,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
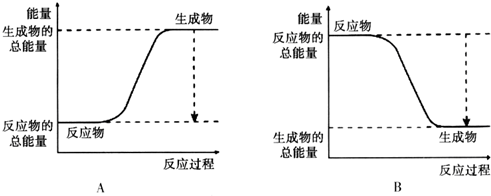
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com