
����Ŀ������ѧѡ��5:�л���ѧ�����������廯����A��һ�ֽ�Ѫ֬ҩ�A������Na��Ӧ����ϳ�·������:

��֪��
I.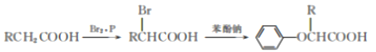
II.RCH==CH2![]() RCH2CH2Br
RCH2CH2Br
III.��C�ĺ˴Ź�������ֻ������壬��������ͼ��ͼ��ʾ:

IV.K�Ľṹ���жԳ���:I�ܷ���������Ӧ��1molI����2molH2�����ӳɷ�Ӧ���Իش���������:
(1)��C�Ļ�ѧ����Ϊ_______________________��
(2)H�����к��еĹ���������Ϊ_____________����Ӧ������Ϊ____________________��
(3)д��J������������Һ������Ӧ�Ļ�ѧ����ʽ:______________________________________��
(4)��Ӧ�ܵĻ�ѧ����ʽΪ:____________________________________________��
(5)��������3��������H��ͬ���칹����____�֣�������ԭ�ӹ������ֲ�ͬ��������(д�ṹ��ʽ)__________________________________________��
������FeCl��Һ��ɫ���ڱ�����ֻ��2��ȡ��������1mol��������������1molNaHCO3��
���𰸡� 2һ����ϩ �Ȼ����Ѽ� ��������ˮ��Һ������ HO-CH2-CH2-CHO+2[Ag(NH3)2]OH![]() HO-CH2-CH2-COONH4+2Ag��+3NH3+H2O 2
HO-CH2-CH2-COONH4+2Ag��+3NH3+H2O 2![]() +HOCH2CH2CH2OH
+HOCH2CH2CH2OH +2H2O 15��
+2H2O 15�� 
��������(1)����֪II��III��֪����C����HBr�ӳɣ���Է�������Ϊ56��������ֻ��������ԭ�ӣ�������CΪCH2=C(CH3)2��������Ϊ2-����ϩ��
(2)����C����֪DΪCH2Br��CH(CH3)2����E��F����������������EΪ������(CH3)2 CH��CH2OH��FΪ(CH3)2CH��COOH��GΪ(CH3)2CBr��COOH��G��B��Ӧ����HΪC6H5O��C(CH3)2��COOH�������ں��еĹ���������Ϊ�Ȼ�����Ӧ�������ˮ�����ɴ������Է�Ӧ����Ϊ��������ˮ��Һ�����ȣ�
(3)��֪I�ܷ���������Ӧ��������CHO����1mol I����2molH2�����ӳɷ�Ӧ������һ��ȩ�����⣬������һ��C=C��������IΪCH2=CH��CHO����ΪK�ǶԳƽṹ������JΪHO��CH2��CH2��CHO��KΪHO��CH2��CH2��CH2OH������J������������Һ������Ӧ�Ļ�ѧ����ΪHO��CH2��CH2��CHO+2[Ag(NH3)2]OH![]() HO��CH2��CH2��COONH4 +2Ag��+3NH3+H2O��
HO��CH2��CH2��COONH4 +2Ag��+3NH3+H2O��
(4)����A�������Ʒ�Ӧ������A������û�л��õ���ԭ�ӣ���K�е������ǻ�����H�е��Ȼ�������������Ӧ����Ӧ�ܵĻ�ѧ����ʽΪ2C6H5O��C(CH3)2��COOH+ HO��CH2 ��CH2��CH2OH ![]() (C6H5O��C(CH3)2��COOCH2)2CH2+2H2O��
(C6H5O��C(CH3)2��COOCH2)2CH2+2H2O��
(5)H��ͬ���칹��������FeCl��Һ��ɫ�����з��ǻ���1molH��������1molNaHCO3��������һ���Ȼ���������һ���ֽṹ��![]() �����ಿ���������ֽṹ���ֱ���
�����ಿ���������ֽṹ���ֱ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ���ֱ�����ֻ��2��ȡ���������������ֽ�������ڡ��䡢��������������Թ�15�ַ���Ҫ���ͬ���칹�壻������ԭ�ӹ������ֲ�ͬ��������
���ֱ�����ֻ��2��ȡ���������������ֽ�������ڡ��䡢��������������Թ�15�ַ���Ҫ���ͬ���칹�壻������ԭ�ӹ������ֲ�ͬ��������![]()
![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��ѧ�ĺ��ľ������û�ѧԭ����Դͷ�ϼ��ٺ�������ҵ�����Ի�������Ⱦ������������������ɫ��ѧ������ǣ� ��
A.����ˮ�ܼ�Ϳ������л��ܼ�Ϳ��
B.�ÿɽ�������������װ�л��ͺ�
C.�÷�Ӧ��Cu+2H2SO4��Ũ�� ![]() ?CuSO4+SO2��+2H2O? �Ʊ�����ͭ
?CuSO4+SO2��+2H2O? �Ʊ�����ͭ
D.�÷�Ӧ��2CH2=CH2+O2 ![]()
![]() �Ʊ���������
�Ʊ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ������
A. ��״���£�VL��̬ϩ��(CnH2n)�����ӵ���ĿΪ![]()
B. 1LFe2(SO4)3��Һ�У���c(Fe3+)=2 molL-1����SO42-����ĿΪ3NA
C. һ��������������۷�Ӧ�ų�0.5mol���壬��ת�Ƶĵ�����һ����1.5NA
D. 46g���ẬH-O������ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���ԭ��ΪN2(g)+3H2(g)![]() 2NH3(g)����ش��������⣺
2NH3(g)����ش��������⣺
��1����֪��1mol H��H����1mol N��N��1mol N��H���ֱ���Ҫ���յ�����Ϊ436kJ��946kJ��391kJ������N2��H2��Ӧ����1mol NH3��Ҫ�ų�_________��������
��2����N2��H2��NH3����ʼŨ������Ϊ0.2mol/L��0.3mol/L��0.2mol/L������Ӧ��ƽ��ʱ��Ũ�ȷֱ���a��b��c��mol/L����������ʵ�Ũ���п��ܵ���___________��
A��c=0.5mol/L B��b=0.5mol/L
C��c=0.4mol/L D��a=0.3mol/L
��3������2L�ܱ������У�����1 mol N2��3mol H2��2minʱ�ﵽƽ�⡣���ƽ��ʱN2��Ũ��Ϊ0.3 mol/L��
��2min��v��NH3��=___________��
��ƽ��ʱ������ѹǿ����ʼʱѹǿ֮��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л�������������������ȷ���ǣ�������
A.2��3��������2���һ�����
B.CH3CH2CH2Cl�ȱ���
C.![]() ���ڷ��㴼
���ڷ��㴼
D.![]() ���ڷ��㻯����
���ڷ��㻯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л�Ϊͬ���칹����ǣ�������
A.��ѿ�Ǻ���
B.���Ǻ���ѿ��
C.���ۺ���ά��
D.���Ǻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�顱���м��ס����㡢��Լ����ɫ���ŵ㣬���й������������ʵ�顱(�г�װ��δ����)��˵����ȷ����(�� ��)

A. ����ʱ�������ϲ��㼯��NH4Cl����
B. ����ʱ��������Һ��죬��ȴ���ֶ���Ϊ��ɫ
C. ����ʱ��������Һ��ɫ��ȥ����ȴ����Һ��죬����SO2��Ư����
D. ���������ʵ�顱���������Ļ�ѧ��Ӧ���ǿ��淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ(������������������ȥ)����֪A��C��������ͬԪ�ؽM�ɵ����ʣ���AĦ������Ϊ65g/mol��C�ǰ�ɫ��ĩ����ɫ��Ӧ�ʻ�ɫ��I�������Һ�壬E��һ�ֺ���ɫ���壬B��F������ɫ���嵥�ʡ�
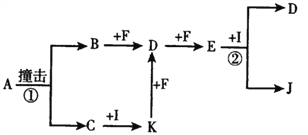
(1)E�Ļ�ѧʽΪ________��
(2)C�ĵ���ʽΪ_________��
(3)�õ���ʽ��ʾI���γ��y��________��
(4)д����Ӧ�ٵĻ�ѧ����ʽ________��
(5)д����Ӧ�ڵ����ӷ���ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.SF6��һ�������ľ�Ե���壬���ӽṹ�У�ֻ����S��F������֪1 mol S(s)ת��Ϊ��̬��ԭ����������280 kJ��F��F����Ϊ160 kJ��mol��1��S��F����Ϊ330 kJ��mol��1����д��S(s)��F2(g)��Ӧ����SF6(g)���Ȼ�ѧ����ʽ_______________________________��
��.V��W��X��Y��Z�������ֶ�����Ԫ���е�2�ֻ�3����ɵ�5�ֻ��������W��X��Z����2��Ԫ����ɣ�X�ǵ�������ЧӦ����Ҫ���壬Z����Ȼ������Ҫ�ɷ֣�Y��W���������ᷴӦ��������ǿ����Һ��Ӧ������5�ֻ������漰������Ԫ�ص�ԭ������֮�͵���28��V��һ�ֽ���Ԫ��A�����ַǽ���Ԫ��B��C��ɣ��仯ѧʽ����ΪA��BC3��3 ������֮��ķ�Ӧ��ϵ����ͼ��

(1)д������W��һ����;��__________________________________________________��
(2)д��V������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��________________________________��
(3)��������Xͨ��ij�����ʵ�ˮ��Һ�п�������Y���÷�Ӧ�����ӷ���ʽΪ________________________________________________________________________��
(4)д������X�Ľṹʽ__________��
(5)��ZΪȼ�ϣ�����̿Ϊ�缫������̼����(������K2CO3)�������Ƴ�ȼ�ϵ�صĸ�����ӦʽΪ_________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com