
如下图所示,其中甲池的总反应式为2CH3OH +3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
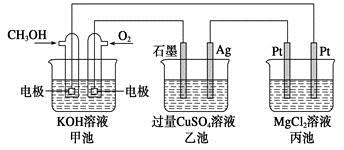
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
D.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
科目:高中化学 来源:2017届河北省高三上月考三化学试卷(解析版) 题型:选择题
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L NaHSO3和NaHCO3的两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(H+)+c(H2RO3)=c(HRO3-)+c(OH-)
C.c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、 c(RO32-) 分别相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
下列各项叙述中,正确的是
A.分子晶体中不一定存在分子间作用力
B.价电子排布为4s24p1的元素位于第四周期第ⅠA族,是S区元素
C.已知金属钛的晶胞是面心立方结构(如图),则钛晶体1个晶胞中钛原子数为4个

D.水是一种非常稳定的化合物,这是由于氢键所导致
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:填空题
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下图是当反应器中按按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:选择题
下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C===C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:填空题
合成氨工业上常用下列方法制备H2 :
:
方法①:C(s)+2H2O(g) CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为_________kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
C(s)+2H2O(g) CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1_________T2(填“>”、“=”或“<”);
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是____________。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
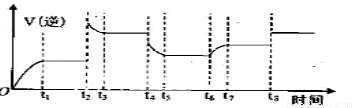
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是_____________,从t1到t8哪个时间段H2O(g)的平衡转化率最低____________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列事实可以证明亚硝酸是弱酸的是( )
① 0. 1 mol/L HNO2溶液的pH=2;
1 mol/L HNO2溶液的pH=2;
② HNO2溶液不与Na2SO4溶液反应;
③ HNO2溶液的导电性比盐酸弱;
④ 25℃时NaNO2溶液的pH大于7;
⑤ 将pH=2的HNO2溶液稀释至原体积的100倍,溶液的pH=3.7
A.①③④ B.①④⑤ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
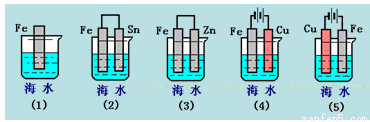
A.(5)(2)(1)(3)(4) B.(2)(5)(3)(4)(1)
C.(5)(3)(4)(1)(2) D.(1)(5)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-个数比为1∶2∶5,欲使这些离子个数比为5∶2∶1,那么要通入Cl2分子个数与原溶液中I-个数比应为( )
A.1∶2 B.2∶1 C.2∶5 D.5∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com