
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献.已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2.)下列说法正确的是()
A. 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI  CeI4+2H2↑
CeI4+2H2↑
B. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+
C. 金属Ce保存时,应该隔绝空气和水
D. 铈的四种核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体
考点: 氧化还原反应;同素异形体.
分析: A、氧化性:Ce4+>Fe3+>I﹣,不会生成CeI4;
B、根据电荷守恒判断即可;
C、根据题中信息分析;
D、具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素同位素.
解答: 解:A、由于氧化性Ce4+>Fe3+>I﹣,铈溶于氢碘酸,产物不会生成CeI4,应该是CeI3,故A错误;
B、离子方程式中,Ce4++2Fe2+=Ce3++2Fe3+,左边总电荷为+8,右边总电荷为9,电荷不守恒,正确应为Ce4++Fe2+=Ce3++Fe3+,故B错误;
C、铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应,所以金属Ce保存时,应该隔绝空气和水,故C正确;
D、核素13658Ce、13858Ce、14058Ce、14258Ce,具有相同质子数,不同中子数,故它们互为同位素,不是同素异形体,故D错误;
故选C.
点评: 本题考查了氧化还原反应、金属性质、同位素等知识,主要是考查分析、利用信息,信息迁移和解决问题的能力,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
|
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
|
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
|
| C. | 用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
|
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,取100 mL某酸溶液,测得其pH等于1,下列叙述正确的是 ( )。
A.该溶液中的c(H+)≥0.1 mol·L-1
B.把该溶液稀释成1 L后,pH≥2
C.把该溶液稀释成1 L后,pH<2
D.完全中和此溶液需0.1 mol·L-1 NaOH的体积≥100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)体积相同、浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同、浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(3)体积相同、pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(4)体积相同、pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).
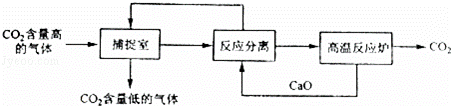
下列有关该方法的叙述中不正确的是()
A. 能耗大是该方法的一大缺点
B. 整个过程中,有2种物质可以循环利用
C. “反应分离”环节中,分离的基本操作是蒸发结晶、过滤
D. “反应分离”环节中,发生了复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或实验原理的说法中正确的是()
A. 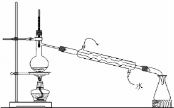 用如图装置进行蒸馏实验
用如图装置进行蒸馏实验
B.  用如图装置吸收氯化氢气体
用如图装置吸收氯化氢气体
C.  用酒精提取溴水中的溴
用酒精提取溴水中的溴
D. 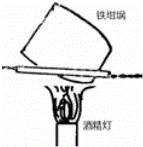 用如图装置灼烧小苏打制取少量的苏打
用如图装置灼烧小苏打制取少量的苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在密闭的容器中,发生可逆反应:xA(g)+yB(g) zC(g),达到平衡时,测得平衡时C的物质的量浓度为0.35 mol·L-1,保持温度不变,将容器容积压缩到原来的一半,再次达到平衡,测得C的物质的量浓度为0.6 mol·L-1,下列有关分析正确是
zC(g),达到平衡时,测得平衡时C的物质的量浓度为0.35 mol·L-1,保持温度不变,将容器容积压缩到原来的一半,再次达到平衡,测得C的物质的量浓度为0.6 mol·L-1,下列有关分析正确是
A. x+y < z B.A的转化率减小
C.B的百分含量减小 D.平衡向正方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某市拟投资建设一个工业酒精厂,目的是用工业酒精与汽油混合制成“乙醇汽油”,以节省石油资源。已知制酒精的方法有三种:
①在催化剂作用下乙烯与水反应;
②CH3CH2Br+H2O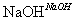 CH3CH2OH+HBr;
CH3CH2OH+HBr;
③(C6H10O5)n(淀粉)+nH2O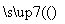 nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
C6H12O6(葡萄糖)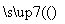 2C2H5OH+2CO2↑。
2C2H5OH+2CO2↑。
(1)方法①的化学反应方程式是_________________________________________。
(2)方法②的化学反应类型是____________。
(3)为缓解石油短缺带来的能源危机,你认为该市应选用哪一种方法生产工业酒精?__________,请简述理由: _______________________________________________________
________________________________________________________________________________________________________________________________________________。
(4)如果从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的一组方法是( )
A.① B.③ C.①③ D.②③ E. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com