
| A. | 碳酸氢钠在水中的电离:NaHCO3═Na++H++CO32- | |
| B. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氯气和水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 铝和烧碱溶液的反应:Al+2OH-═AlO-2+H2↑ |
分析 A.碳酸氢钠电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开;
B.钠与水反应生成氢氧化钠和氢气;
C.次氯酸为弱酸,离子方程式中拆开不能拆开,应该保留分子式;
D.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒、电荷守恒.
解答 解:A.碳酸氢根离子不能拆开,正确的离子方程式为:NaHCO3=Na++HCO3-,故A错误;
B.钠与水的反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B正确;
C.氯气和水反应生成的次氯酸是弱酸,应该用化学式表示,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故C错误;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:选择题
| A. | C4H8O2的酯有4种结构 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 用氢氧化钠溶液可以鉴别地沟油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
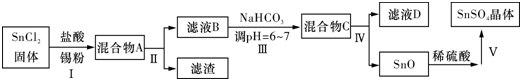
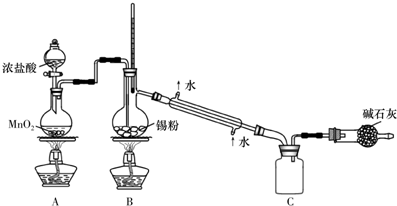
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 常温下,11.2 L Cl2 气所含原子数为NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO42-、NO3-、Ba2+ | B. | K+、Cl-、CO32-、Na+ | ||
| C. | Cu2+、NO3-、OH-、Na+ | D. | K+、SO42-、HCO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时,切取绿豆粒大小的金属钠,用滤纸吸干表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 用蒸馏法提纯物质时,如果把温度计水银球位于蒸馏烧瓶支管口下方,会使收集的产品中混有低沸点的杂质 | |
| C. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸,加热3~5min,将导气管插入饱和Na2CO3溶液中以便于除去乙醇和乙酸 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s 的平均速率 (PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时 (PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前 (正)>(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
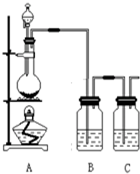 为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:
为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com