
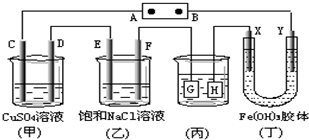
| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 |
分析 A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极;
B、甲装置中C电极上氢氧根离子放电,D电极上铜离子放电,E电极上氯离子放电,F电极上氢离子放电,根据得失电子和生成物的关系式计算;
C、电镀时,镀层作阳极,镀件作阴极,电解质溶液中金属阳离子与阳极材料是相同的元素;
D、电解池中带正电荷的微粒向阴极移动,带负电荷的微粒向阳极移动.
解答 解:A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,故A错误;
B、甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的C、D、E、F电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol铜时需要2mol电子,生成1mol氯气时需要2mol电子,生成1mol氢气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2:2:2,故B正确;
C、若用(丙)装置给铜镀银,G应该是Ag,H是铜,电镀液是AgNO3溶液,故C错误;
D、丁装置中Y电极是阴极,如果Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷,故D错误.
故选B.
点评 本题考查了电解池原理,能正确判断电解池的阴阳极是解本题的关键,明确电泳现象证明了胶粒带电.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | baXn-中含有的中子数为a+b | B. | baXn-中含有的电子数为a-n | ||
| C. | X原子的质量约为(b/NA)g | D. | 此元素的相对原子质量为b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量稀HNO3中加入足量铁粉:Fe+4H++NO3-═NO↑+Fe3++2H2O | |
| B. | 以石墨作电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | NH4HCO3溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | e电极上可以析出使湿润的淀粉KI试纸变蓝的气体 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内溶液的pH升高 | |
| D. | B烧杯中加一定量的KCl固体可恢复原状 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R:0.08mol•L-1 | B. | Q:0.05mol•L-1 | C. | X:0.12mol•L-1 | D. | Y:0.06mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特性是丁达尔现象 | |
| B. | 利用半透膜可除去淀粉溶液中的少量NaCl | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 加入电解质,胶体一定能发生凝聚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com