
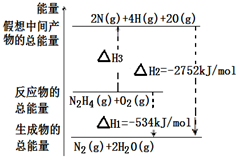
 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则分析 (1)由图可知反应物的总能量高于生成物的总能量;
(2)根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可.
解答 解:(1)肼和氧气燃烧反应中,反应物的总能量大于生成物的总能量,故答案为:大于;
(2)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol-534kJ/mol=2218kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,
设断裂1molN-H键所需的能量为K,旧键断裂吸收的能量:154+4K+500=2218,解得K=391,
故答案为:391.
点评 本题考查学生化学键的断裂和生成与反应的吸放热之间的关系,考查学生知识的灵活应用情况,难度不大.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒 | |
| B. | “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适 | |
| C. | 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: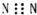 | |
| B. | 甲烷分子的比例模型是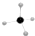 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅制作的光导纤维遇强碱会“断路” | |
| B. | 煤的综合利用主要是通过煤的干馏、液化和气化以获得洁净的燃料和多种化工原料 | |
| C. | 氢气燃烧能放出大量的热量,燃烧产物是水,所以是理想的清洁燃料 | |
| D. | 化学电源有一次电池和二次电池之分,一次电池用过之后不能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu (CuO),加盐酸,过滤 | B. | Na2CO3 (NaHCO3)固体,加热 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com