
| A. | 离子化合物一定易溶于水 | |
| B. | 离子化合物由非金属元素和金属元素共同组成 | |
| C. | 熔融状态下能够导电的物质,一定是离子化合物 | |
| D. | 离子化合物在固态时有离子存在,但不导电 |
分析 A.离子化合物不一定易溶于水;
B.离子化合物可能全部是由非金属元素组成的;
C.熔融状态下能导电的物质可能是金属单质;
D.含有自由移动离子的离子化合物能导电.
解答 解:A.离子化合物不一定易溶于水,如难溶性离子化合物硫酸钡、AgCl等,故A错误;
B.离子化合物可能全部是由非金属元素组成的,如铵盐,故B错误;
C.熔融状态下能导电的物质可能是金属单质,如Fe、Al等,故C错误;
D.含有自由移动离子的离子化合物能导电,固态离子化合物中含有离子但没有自由移动的离子,所以其固态不导电,故D正确;
故选D.
点评 本题考查离子化合物的判断,侧重考查基本概念,不能根据物质的溶解性、是否含有金属元素等特点确定离子化合物,要根据物质的构成微粒判断,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 大烧杯上没有盖硬纸板 | |
| B. | 用环形铜丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 | |
| D. | 用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学家们正在研究利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气 | |
| B. | 贮氢金属在一定温度和压强下可以吸附氢气,如镧镍合金(LaNi5)可以吸附氢气形成LaNi5H6,其中H元素仍以H2分子形式存在 | |
| C. | 生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体不可直接排放 | |
| D. | 2013年3月底,H7N9型禽流感在上海和安徽两地率先发现.要杀死禽流感病毒可通过消毒剂杀菌,通过加热煮沸杀菌,也可用紫外线照射杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
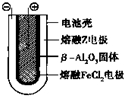 Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠原子 | ||
| C. | 单质的熔点逐渐增大 | D. | 原子半径随核电荷数的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=3 | |
| B. | 金属R的相对原子质量为56 | |
| C. | y=2 | |
| D. | 电解后溶液的pH=1(电解过程中溶液体积变化忽略不计) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com