
分析 (1)①2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高;根据化合价的变化分析;
②鉴别NaNO2,利用2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝分析;
③NaNO2直接排放会造成污染,需要具有还原性的物质将其氧化生成氮气;
(2)由信息可知,铝粉与石墨、TiO2反应生成TiC和另一种耐高温的物质,结合元素守恒可知生成氧化铝,以此来解答.
解答 解:(1)①2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高,则NaNO2为氧化剂,氧化剂与还原剂的物质的量之比为1:1,有0.75mol的还原剂被氧化,则被还原的氧化剂有0.75mol,
故答案为:NaNO2;0.75;
②鉴别NaNO2和NaCl,由2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝可知,则选择试剂为②⑤,
故答案为:②⑤;
③NaNO2直接排放会造成污染,需要具有还原性的物质将其氧化生成氮气,则选择氯化铵即可,发生NaNO2+NH4Cl═NaCl+N2↑+2H2O,其余选项不符合,
故答案为:②;
(2)由信息可知,铝粉与石墨、TiO2反应生成TiC和另一种耐高温的物质,结合元素守恒可知生成氧化铝,反应为4Al+3C+3TiO2$\frac{\underline{\;加热\;}}{\;}$3TiC+2Al2O3,
故答案为:4Al+3C+3TiO2$\frac{\underline{\;加热\;}}{\;}$3TiC+2Al2O3.
点评 本题考查氧化还原反应和物质的鉴别及Al的化学性质,为高频考点,把握习题中的信息及质量守恒定律为解答的关键,侧重氧化还原反应方程式书写及分析应用能力的考查,题目难度不大.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
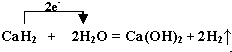 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
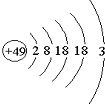 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In为过渡金属元素 | ||
| C. | In容易导电导热 | D. | In在反应中容易失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1648.7 kJ.mo1-1 | B. | -1255.3 kJ.mol-1 | ||
| C. | -861.7 kJ.mol-l | D. | +867.1 kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、OH-、Cl- | B. | Ba2+、K+、SO42-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Al3+、Cl-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com