
【题目】硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物.一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如下: 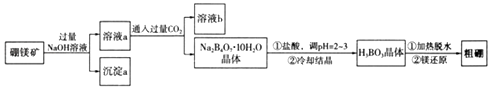
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为 .
(2)溶液b中溶质的化学式为 .
(3)用pH试纸测溶液pH的操作方法是 .
(4)写出Mg2B2O5H2O与盐酸反应的化学方程式:
(5)制得的粗硼在一定条件下生成BI3 , BI3加热分解可以得到纯净的单质硼.现将0.0200g粗硼制成的BI3完全分解,生成的I2用0.3000mo1.L﹣1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液15.00mL.(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)
①滴定操作中指示剂通常为
②该粗硼样品的纯度为 .
③若滴定管在使用前未用Na2S2O3标准溶液润洗,测得样品的纯度将(填“偏高”、“偏低”或“无影响”).
(6)请仿照如图形式设计从沉淀a中获得单质Mg的流程图(提示:在箭头上方或下方标出所用试剂或实验操作). ![]()
【答案】
(1)+3
(2)NaHCO3
(3)把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较
(4)Na2B4O7?10H2O+2HCl=2NaCl+5H2O+4H3BO3
(5)淀粉溶液;82.5%;偏高
(6)![]()
【解析】解:(1)根据化合价代数和为0,可知Mg2B2O5H2O中B的化合价为+3,所以答案是:+3;(2)由上述分析可知,通入过量二氧化碳,则得溶液b为NaHCO3 , 所以答案是:NaHCO3;(3)用pH试纸测溶液pH的操作方法是把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较;所以答案是:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较;(4)Na2B4O710H2O与盐酸反应根据强酸制弱酸的原理生成氯化钠、水和硼酸,反应方程式为:Na2B4O710H2O+2HCl=2NaCl+5H2O+4H3BO3 ,
所以答案是:Na2B4O710H2O+2HCl=2NaCl+5H2O+4H3BO3;(5)①滴定过程中有碘单质参与,可以使用淀粉溶液作为指示剂;所以答案是:淀粉溶液;
②硫代硫酸钠的物质的量为:0.3mol/L×0.015L=0.0045mol,根据关系式:B~BI3~ ![]() I2~3S2O32﹣ , n(B)=
I2~3S2O32﹣ , n(B)= ![]() n(S2O32﹣)=0.0015mol,
n(S2O32﹣)=0.0015mol,
硼的质量为:11g/mol×0.0015mol=0.0165g,粗硼中硼的含量为: ![]() ×100%=82.5%,
×100%=82.5%,
所以答案是:82.5%;
③若滴定管在使用前未用Na2S2O3标准溶液润洗,则测得Na2S2O3标准溶液体积偏大,所以根据B~BI3~ ![]() I2~3S2O32﹣ , 样品的纯度将偏高,所以答案是:偏高;(6)沉淀a为Mg(OH)2固体,加浓盐酸蒸发结晶得MgCl26H2O晶体,因为MgCl26H2O受热易水解生成氢氧化镁,所以在HCl的气流中加热得到MgCl2固体,最后再电解熔融MgCl2固体得到镁,所以从沉淀a中获得单质Mg的流程图为
I2~3S2O32﹣ , 样品的纯度将偏高,所以答案是:偏高;(6)沉淀a为Mg(OH)2固体,加浓盐酸蒸发结晶得MgCl26H2O晶体,因为MgCl26H2O受热易水解生成氢氧化镁,所以在HCl的气流中加热得到MgCl2固体,最后再电解熔融MgCl2固体得到镁,所以从沉淀a中获得单质Mg的流程图为 ![]() ,
,
所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 .
请回答下列问题:
(1)图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;
(2)图中△H=kJmol﹣1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05molL﹣1min﹣1 , 则υ(O2)=molL﹣1min﹣1、υ(SO3)=molL﹣1min﹣1;
(5)已知单质硫的燃烧热为296kJmol﹣1 , 计算由S(s)生成3molSO3(g)的△H(要求计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.实验室用加热NH4Cl固体的方法制备NH3
B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.工业上用SO2漂白纸浆、毛、丝、草帽辫等
D.保存金属钠的仓库着火可以用二氧化碳灭火器去灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)![]() 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
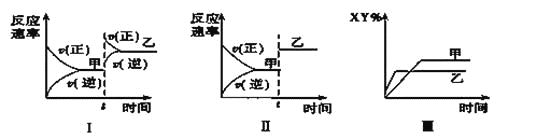
A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂.摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物.某学习小组欲探究其分解产物.
(1)甲组同学设计了如图1所示实验装置. 
(i)实验中,装置B中观察到的现象是 .
(ii)碱石灰的主要作用是 .
(iii)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有(写化学式).
(iv)设计实验验证装置A中固体残留物不含FeO:(简要说明实验操作、现象和结论).
(2)乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2 . 为进行验证,用甲组实验中的装置A和下列如图2所示装置进行实验.
说明此固体产物不含FeO|多余
(i)乙组同学的实验装置中,依次连接的合理顺序为A、 . 装置G中盐酸的作用是
(ii)实验中,准确称量摩尔盐7.8400g,充分加热反应后,测得装置A中固体残留物的质量为1.6000g,装置G中生成白色沉淀的质量为3.4950g,装置H中收集到112mL N2(标准状况下),写出摩尔盐受热分解的化学方程式: . (分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2OH(CHOH)4CHO是葡萄糖的结构简式,它不可能发生的化学反应是( )
A.燃烧
B.银镜反应
C.水解反应
D.与新制备的Cu(OH)2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com